Course de barrières de médicaments
2002/12/01 Galarraga Aiestaran, Ana - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
L'homme a toujours cherché des substances qui guérissent ou soulager les maladies. Au début, ils étaient principalement obtenus à partir de plantes et d'animaux, mais depuis la Seconde Guerre mondiale, la synthèse chimique et la biotechnologie ont aidé la plupart des nouveaux médicaments. Dans l'obtention
et la commercialisation d'un nouveau médicament interviennent des spécialistes dans des domaines aussi divers que la chimie, la biologie moléculaire, la pharmacie de base et clinique, l'économie et la statistique. Au travail intellectuel, il faut ajouter l'argent, car on sait que les industries pharmaceutiques obtiennent d'énormes bénéfices grâce à une série de médicaments prestigieux, mais il est également vrai que les recherches sont coûteuses et durent de nombreuses années. Lorsqu'un médicament est commercialisé, il peut passer entre 10 et 15 ans et la recherche peut coûter entre des dizaines et des centaines de millions d'euros.
Recherche de molécule moteur
La recherche d'un nouveau médicament commence par la recherche d'ingrédients actifs potentiels. Le composant actif est le cœur du médicament, avec des effets pharmacologiques. Auparavant, la plupart des plantes étaient obtenues : en voyant que les effets d'une plante sur les animaux et sur les êtres humains étaient favorables, on concluait qu'elle servait à la guérir. Par la suite, il a été tenté d'identifier et d'isoler le composant actif des plantes traditionnellement utilisées en médecine, afin de le synthétiser en laboratoire.
Parallèlement, de nouvelles molécules ayant un potentiel curatif ont été mises en œuvre et testées, mais la recherche était aveugle, n'était pas basée sur la méthode scientifique.
Actuellement, la recherche est basée sur la connaissance des mécanismes de la maladie. Sachant que la maladie provoque des changements biochimiques et cellulaires, les chercheurs cherchent à rechercher les substances qui font face à ces changements. Il s'agit d'identifier le récepteur et synthétiser la molécule qui l'unit. Ainsi, en associant cette molécule au récepteur, on obtient d'augmenter ou d'inhiber l'activité que la cellule aurait d'elle-même.
En d'autres occasions, l'objectif est d'améliorer une molécule déjà connue et pour cela les changements structurels sont mis à l'épreuve ; parfois, il suffit de modifier légèrement la structure pour augmenter considérablement l'efficacité ou la rendre apte à un autre usage.
Il peut également arriver que nous trouvions aléatoirement le composant actif d'un nouveau médicament. Ainsi, par exemple, avec la pénicilline. L'histoire est connue: Tandis que Alexander Fleming travaillait avec le virus de la grippe, il a découvert que dans certaines cultures bactériennes quelque chose empêchait la prolifération de la bactérie Staphylococcus, une culture bactérienne qui était endeuillée et que le coupable était une substance de moisissure. Et ainsi découvert la pénicilline, l'antibiotique le plus utilisé depuis de nombreuses années.
Claudio Palomo, professeur à la Faculté de Chimie de l'UPV/EHU à Donostia, considère que l'instinct a une grande importance dans la recherche de nouveaux médicaments. En fait, une molécule trouvée au hasard est testée dans la section de chimie organique; bien que la recherche soit dans les premières phases, les résultats sont très satisfaisants.
Cependant, tout ne peut pas être attribué au hasard; la découverte de Fleming a eu lieu en 1928, mais à la fois en 1875 et en 1925 d'autres chercheurs qui ont écrit que la moisissure avait un effet antibactérien, mais n'ont pas pu approfondir plus. Donc, pour trouver un nouveau médicament, la chance ne suffit pas.
Premiers tests

Dans tous les cas, la prochaine étape consiste à synthétiser quelques grammes. Avec eux, les premiers tests de la molécule candidate sont effectués. Souvent, les molécules sont très efficaces dans les essais, mais très peu dépassent les tests avant le début des essais cliniques et, bien sûr, sont moins celles qui arrivent à la fin. Selon les données des États-Unis, sur les 5.000 composés qui commencent à être étudiés en laboratoire, seulement cinq sont testés chez les humains. Et un seul de ces cinq est suffisamment efficace et sûr pour accéder à la clinique médicale.
Le but des premiers tests est de connaître en détail les caractéristiques du composant actif : caractéristiques physico-chimiques, stabilité, solubilité, etc. En outre, on analyse in vitro l'influence du composant par des systèmes non cellulaires (dans des préparations enzymatiques) et des cultures cellulaires animales ou humaines.
Premiers pas à la Faculté de Chimie de Saint-Sébastien de l'UPV

En Euskal Herria, l'université, l'hôpital et le laboratoire travaillent ensemble pour obtenir de nouveaux médicaments. Le département de chimie organique de la faculté de chimie de l'UPV/EHU est l'un des participants à ce travail. C'est là que la première étape est franchie, c'est-à-dire que de nouveaux composants actifs sont recherchés.
Ils ont plusieurs voies de recherche. Il y a quelques années, ils ont développé une méthodologie propre de création de peptides. Les peptides sont des molécules composées de 3-4 acides aminés qui, bien que petits, peuvent influencer. En ce moment, on étudie un de ces peptides. Selon le professeur Iñaki Gamboa, le processus n'est pas facile, mais on pense que s'il va bien, c'est une étape importante.
Pharmacologique au médicament
Pour avancer, il faut faire une autre étape importante : faire le médicament avec le médicament. Le médicament et le médicament sont généralement considérés comme synonymes, mais comme l'explique José Luis Pedraz, professeur à la Faculté de pharmacie de l'UPV/EHU à Vitoria-Gasteiz, ce n'est pas la même chose : le médicament est une molécule à effet pharmacologique que la préparation à guérir.

Le travail des pharmaciens consiste à élaborer une préparation avec laquelle des patients peuvent être administrés. La préparation, en plus de pouvoir être ingérée par une voie ou une autre, doit remplir d'autres caractéristiques comme être stable, détacher le composant actif après son administration et être capable d'actionner. Tout cela n'est pas facile et vous devrez peut-être vous passer d'une molécule candidate efficace parce que vous ne pouvez pas préparer le médicament. Pedrat pense que l'un des défis de la pharmacologie actuelle est que les gènes ou fragments d'ADN et de molécules puissantes sont capables de devenir des médicaments. Et c'est que, bien qu'ils puissent être très utiles pour guérir les maladies, il n'est pas encore possible de les prendre comme d'autres médicaments.
Lorsque le médicament est préparé avec la molécule motrice, les tests de toxicité sur les animaux commencent. Les premières sessions sont effectuées avec la souris, d'une part parce qu'étant de petites quantités ne sont pas nécessaires et d'autre part parce qu'il existe des procédures réglées sur la souris pour mesurer la toxicité. Par la suite, des tests sont effectués avec des animaux plus grands.
Ces séances analysent l'intervalle entre la dose létale et la dose effective; plus l'intervalle est élevé, plus le médicament est sûr. En outre, on observe les effets néfastes qui se manifestent, immédiatement et à long terme, comme pour les générations futures.
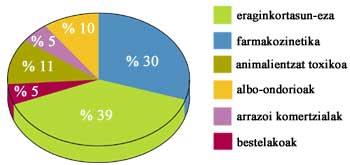
Mesurer la sécurité du médicament chez l'homme
Lorsque les résultats de tous les tests ci-dessus sont satisfaisants, il faut voir quel effet le médicament a sur l'homme. Pour cela, des séances cliniques sont organisées et les effets thérapeutiques et les effets néfastes sont analysés. Selon les résultats, il est déterminé s'il sert ou non à la thérapie et, s'il est valide, on détermine les doses et la posologie (quand et combien).
Les séances cliniques sont divisées en quatre phases en fonction des objectifs. Les objectifs principaux de ces quatre phases sont respectivement l'analyse de la sécurité, la mesure de l'efficacité, la comparaison avec d'autres médicaments et le suivi et l'approfondissement des recherches une fois commercialisées.
Dans une première phase, il faut donc montrer que le médicament est sûr. L'importance de cette phase est énorme, car jusqu'alors cette substance n'a jamais été testée chez les humains. Et si les résultats ne sont pas bons, la recherche est immédiatement suspendue. Les tests sont effectués avec des volontaires sains et il faut souligner qu'ils sont conscients de ce que ce médicament peut causer et qu'ils peuvent l'abandonner quand ils le souhaitent.
Au début des séances cliniques, il est plus difficile de décider quelle dose utiliser. Le point de départ est l'expérimentation animale, avec une dose initiale de 1-2% de l'efficacité des animaux et une dose maximale de 10-16% du maximum autorisé par les animaux. Dans les premières études, une seule dose est administrée, et après avoir vu ce qui se passe, vous décidez si donner la prochaine ou non. Lentement, la dose augmente jusqu'à ce que des effets inacceptables sont détectés.
Avec le moins de participants possible (30-100), l'objectif est d'obtenir le maximum d'informations possibles. Pour voir comment le corps prend le médicament, on mesure les constantes vitales et l'activité cardiaque et on effectue des analyses de sang et d'urine. Des études pharmacodynamiques (médicaments et leurs effets sur le corps) et pharmacocinétiques (comment le métabolisme du corps affecte le médicament) sont effectuées et leur interaction avec d'autres aliments et/ou médicaments est observée. Tout cela montre si c'est sûr ou non. Les tests servent également à décider quand et comment les gérer.
Unité de développement pharmaceutique de Vitoria-Gasteiz

Le travail commencé à la Faculté de Chimie de San Sebastián pourrait se poursuivre à la Faculté de Pharmacie de Vitoria-Gasteiz. En particulier, au sein de la Fondation LEIA, l'Unité de Développement Pharmaceutique est composée du Département de Pharmacie et de Technologie Pharmaceutique et de l'Unité d'Essais Cliniques de l'Hôpital de Txagorritxu.
À la Faculté de Pharmacie, ils étudient les molécules candidates et définissent leurs caractéristiques. S'ils voient qu'une molécule est valide, ils préparent le médicament. Par la suite, l'Unité d'essais cliniques de l'hôpital de Txagorritxu organise des sessions avec des volontaires de la première phase. Les tests sanguins et urines à effectuer sont également effectués dans cette section de pharmacie. Si tout va bien, ils passent à la deuxième phase des séances cliniques, mais pour cela ils ont besoin de la collaboration d'autres hôpitaux.
De plus, les médicaments génériques sont préparés et testés à Vitoria-Gasteiz, dont certains sont commercialisés par le laboratoire Litaphar d'Azpeitia.
Bien sûr, mais... Est-il efficace ?

Dans une deuxième phase, on analyse la guérison du médicament. Jusque-là, vous avez seulement regardé la sécurité, mais la non-condition ne signifie pas que vous bénéficiez. Dans une deuxième phase, des tests sont effectués pour vérifier l'effet bénéfique potentiel et déterminer les normes et les doses les plus appropriées pour l'administration du médicament.
La deuxième phase dure entre un et trois ans et nécessite la participation de 100 à 400 personnes, dont certaines patients. Enfin la relation dose-effet est connue. Dans les séances, il y a toujours un groupe de contrôle et les examens sont généralement aléatoires et aveugles, c'est-à-dire que le participant ne sait pas si vous prenez le médicament ou le placebo. Des séances doubles aveugles sont parfois organisées, c'est-à-dire que le chercheur qui donne la médecine aux participants ne sait pas ce qu'il prend. De cette façon, les résultats sont plus objectifs.
Dernière phase pré-commerciale
La troisième phase reprend les derniers tests effectués avant la commercialisation du médicament. Dans cette phase, le médicament est comparé à d'autres médicaments existants sur le marché et à usage thérapeutique égal. En outre, les examens sont effectués comme si les patients étaient en situation normale, c'est-à-dire qu'ils doivent prendre la dose à la même heure et dans le même état où ils devraient prendre le médicament, suivre l'activité normale et la nourriture...

Il ne faut pas oublier que le médicament est destiné aux patients. Les volontaires de la troisième phase doivent donc remplacer au mieux les patients qui recevront le médicament. Cependant, il n'est pas toujours facile, car la réalisation de tests avec les malades, les vulnérables, les enfants, les personnes âgées et les femmes enceintes génère des problèmes éthiques.
Ces équipes sont plus vulnérables que les autres, de sorte que certains chercheurs les excluent des tests. La surprotection, cependant, n'est généralement pas bénéfique parce que la population exclue dans les essais, si un jour vous avez besoin de ce médicament, personne ne saura quel sera son effet.
En dehors de cela, vous devez avoir très clair ce que vous voulez obtenir dans la troisième phase, combien de temps et combien d'argent vous voulez dépenser. En fait, de nombreux nouveaux médicaments sont plus efficaces que ceux existants, mais il faut voir à quel point la différence est si grande que souvent il n'est pas très grand. Dans ces cas, il est peut-être préférable de suspendre l'enquête, car la différence ne mérite pas autant d'argent et de temps.
Après le licenciement, il faut continuer à enquêter

Avec toutes les informations recueillies dans les trois premières phases des sessions cliniques, les rapports de demande d'autorisation de commercialisation sont élaborés. Compte tenu de l'endroit où vous souhaitez commercialiser, les rapports sont envoyés à l'Agence espagnole des médicaments, à l'Agence européenne ou à la Food and Drug Administration (FDA) des États-Unis. afin qu'après analyse approfondie, ils autorisent ou déniègent le licenciement.
Mais au moment de décider, cela prend souvent beaucoup de temps, car ils demandent souvent que les données soient complétées ou que davantage de preuves soient faites. Selon Lidia Larrañaga, directrice technique du laboratoire Litaphar d'Azpeitia, ce processus dure environ un an pour les médicaments génériques. Logiquement, lorsque le médicament est complètement nouveau, le processus d'obtention de l'autorisation s'allonge beaucoup.
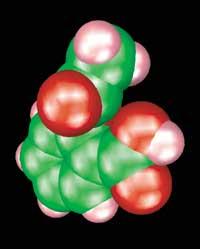
Une fois autorisé, le médicament est mis sur le marché. C'est alors que commence la quatrième phase des séances cliniques. L'objectif de cette phase est de suivre l'efficacité et la sécurité du médicament. Il arrive souvent, par exemple, que les doses établies sont trop élevées, de sorte qu'il est republié avec des doses plus faibles. Dans une moindre mesure, des effets secondaires graves peuvent apparaître chez certains groupes de la population qui n'ont pas été détectés lors de séances cliniques. Cela peut vous obliger à retirer le médicament du marché.
D'autres fois, grâce aux études menées à ce stade, on trouve de nouvelles utilisations. Par exemple, l'aspirine est présente sur le marché depuis 105 ans. Au début, il est sorti pour éliminer la douleur et traiter les inflammations, mais maintenant on sait qu'il est également bénéfique pour prévenir les infarctus et des tests sont en cours pour l'utiliser dans la lutte contre le cancer.
Il est clair que le lancement d'un nouveau médicament est un travail pénible, long et coûteux. En contrepartie, il existe des remèdes contre de nombreuses maladies. Cependant, il est parfois abusé du médicament et la prise de mesure dépend du médecin et de chacun.
L'avenir commence aujourd'hui
XX. La pharmacologie du XXe siècle a beaucoup progressé grâce à la chimie, la pharmacologie et la clinique. Les experts estiment désormais que les progrès seront axés sur la biologie moléculaire, le génome et la protéome, la biotechnologie, la chimie combinatoire, la bioinformatique et la robotique.

Certes, l'identification des gènes a supposé une nouvelle façon de comprendre les maladies. Connaissant le contrôle génétique des fonctions de la cellule, de nouvelles voies sont ouvertes pour prévenir ou guérir des maladies. Indépendamment de la thérapie génique, la connaissance du génome conduit à découvrir les destinations des nouveaux médicaments. Protéomique, pour sa part, analyse le produit du génome, donc complète le précédent.
D'autre part, il existe des différences entre les groupes ethniques au moment de métaboliser les médicaments, et il est possible qu'un médicament qui bénéficie à la majorité puisse causer des dommages à certains. La pharmacienne étudie la relation entre le génotype individuel et la capacité de métabolisation des médicaments.
La chimie combinatoire a été une avancée majeure dans la chimie de synthèse. La technologie actuelle permet d'obtenir des molécules d'intérêt plus rapidement que jamais. Pour connaître lesquelles de ces molécules sont vraiment de valeur thérapeutique, des méthodes rapides de dépistage à haute efficacité sont utilisées. Ainsi, on connaît avec précision et rigueur les distinctions entre 50.000 et 60.000 molécules par semaine. Tout cela est dû à la bioinformatique comme outil indispensable pour la compréhension rapide et le traitement de tant de données.
Cependant, les substances naturelles ayant une capacité curative ne doivent pas être évitées. Jusqu'à présent, seulement 10% des ressources de la Terre ont été exploitées, donc il reste encore beaucoup de trésors cachés. Pour être conscient de son importance, il suffit de voir quels sont les médicaments les plus vendus, comme la cyclosporine, la lobastatine, la clarithromycine, la pravatatine et l'altobastatine, neuf des dix médicaments non protéiques les plus vendus l'année dernière aux États-Unis.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia