Carrera de barreres de medicaments
2002/12/01 Galarraga Aiestaran, Ana - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
L'home sempre ha buscat substàncies que curen o alleugen les malalties. Al principi s'obtenien principalment de plantes i animals, però des de la Segona Guerra Mundial, la síntesi química i la biotecnologia han ajudat a la majoria dels nous medicaments. En l'obtenció
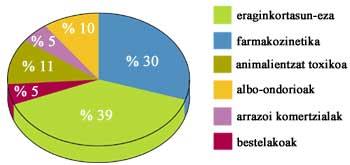
i comercialització d'un nou medicament intervenen especialistes en àrees tan diverses com la química, la biologia molecular, la farmàcia bàsica i clínica, l'economia i l'estadística. A la labor intel·lectual cal afegir els diners, ja que se sap que les indústries farmacèutiques obtenen enormes beneficis gràcies a una sèrie de prestigiosos medicaments, però també és cert que les recerques són costoses i duren molts anys. Quan es comercialitza un medicament poden passar entre 10 i 15 anys i la recerca pot costar entre desenes i centenars de milions d'euros.
Cerca de la molècula motriu
La cerca d'un nou medicament comença amb la cerca de possibles components actius. El component actiu és el cor del fàrmac, amb efectes farmacològics. Abans, la majoria s'obtenien de les plantes: en veure que els efectes d'una planta sobre els animals i sobre els éssers humans eren favorables, es concloïa que servia per a curar-la. Posteriorment, es va intentar identificar i aïllar el component actiu de les plantes utilitzades tradicionalment en medicina, amb la finalitat de sintetitzar-lo en el laboratori.
Paral·lelament, es van començar a realitzar i provar noves molècules amb potencial curatiu, però la cerca era cega, no estava basada en el mètode científic.
En l'actualitat, la cerca es basa en el coneixement dels mecanismes de la malaltia. Sabent que la malaltia provoca canvis bioquímics i cel·lulars, els investigadors tracten de buscar les substàncies que afronten aquests canvis. Es tracta d'identificar el receptor i sintetitzar la molècula que l'uneix. D'aquesta forma, en associar aquesta molècula al receptor, s'aconsegueix augmentar o inhibir l'activitat que la cèl·lula tindria de per si mateix mateixa.
En altres ocasions, l'objectiu és millorar una molècula que ja es coneix i per a això es posen a prova els canvis estructurals; a vegades, n'hi ha prou amb modificar lleugerament l'estructura per a augmentar considerablement l'eficiència o convertir-la en apta per a un altre ús.
També pot ocórrer que trobem aleatòriament el component actiu d'un medicament nou. Així va ocórrer, per exemple, amb la penicil·lina. La història és coneguda: Mentre Alexander Fleming treballava amb el virus de la grip, va descobrir que en algunes cultures bacterianes alguna cosa impedia la proliferació del bacteri Staphylococcus, una cultura bacteriana que estava arrebossada i que el culpable era una substància de la floridura. I així va descobrir la penicil·lina, l'antibiòtic més utilitzat durant molts anys.
Claudio Palomo, catedràtic de la Facultat de Química de la UPV/EHU en Donostia, considera que l'instint té una gran importància en la cerca de nous fàrmacs. De fet, en la secció de Química Orgànica s'està provant una molècula trobada a l'atzar; encara que la recerca es troba en les primeres fases, els resultats són molt satisfactoris.
No obstant això, no tot es pot atribuir a l'atzar; el descobriment de Fleming va tenir lloc en 1928, però tant en 1875 com en 1925 altres investigadors que van escriure que la floridura tenia un efecte antibacteriano, però no van ser capaços d'aprofundir més. Així que per a trobar un nou medicament, la sort no és suficient.
Primeres proves

En tots els casos, el següent pas és sintetitzar uns grams. Amb ells es realitzen les primeres proves de la molècula candidata. Sovint les molècules són molt efectives en els assajos, però molt poques superen les proves prèvies a l'inici dels assajos clínics i, per descomptat, són menys les que arriben al final. Segons dades dels EUA, dels 5.000 compostos que comencen a estudiar-se en el laboratori, només cinc arriben a provar-lo en humans. I només un d'aquests cinc és prou eficaç i segur com per a accedir a la clínica mèdica.
L'objectiu de les primeres proves és conèixer detalladament les característiques del component actiu: característiques físic-químiques, estabilitat, solubilitat, etc. A més, s'analitza in vitro la influència del component mitjançant sistemes no cel·lulars (en preparats enzimàtics) i cultius cel·lulars animals o humans.
Primers passos en la Facultat de Química de Sant Sebastià de la UPV

A Euskal Herria, la universitat, l'hospital i el laboratori treballen junts per a aconseguir nous medicaments. El departament de Química Orgànica de la Facultat de Química de la UPV/EHU és un dels participants en aquest treball. És aquí on es fa el primer pas, és a dir, es busquen nous components actius.
Tenen diverses vies de cerca. Fa uns anys van desenvolupar una metodologia pròpia de creació de pèptids. Els pèptids són molècules formades per 3-4 aminoàcids que, encara que petits, poden influir. Ara mateix s'està estudiant un d'aquests pèptids. Segons el professor Iñaki Gamboa, el procés no és gens fàcil, però es creu que si surt bé és un pas important.
Farmacològic a medicament
Per a avançar cal fer un altre pas important: fer el medicament amb el fàrmac. Normalment es consideren sinònims el fàrmac i el medicament, però segons explica José Luis Pedraz, catedràtic de la Facultat de Farmàcia de la UPV/EHU a Vitòria-Gasteiz, no són el mateix: el fàrmac és una molècula d'efecte farmacològic que el preparat per a curar.

La labor dels farmacèutics consisteix en l'elaboració d'un preparat amb el qual es puguin administrar pacients. El preparat, a més de poder ser ingerit per l'una o l'altra via, ha de complir altres característiques com ser estable, desprendre el component actiu després de la seva administració i ser capaç d'accionar. Tot això no és gens fàcil i pot ser que hagi de prescindir d'una molècula candidata efectiva perquè no es pot preparar el medicament. Pedrat creu que un dels desafiaments de la farmacologia actual és que els gens o fragments d'ADN i molècules potents, siguin capaces de convertir-se en medicaments. I és que, encara que poden ser molt útils per a curar malalties, encara no és possible prendre-les com altres medicaments.
Quan s'aconsegueix preparar el medicament amb la molècula motriu, comencen les proves de toxicitat en els animals. Les primeres sessions es realitzen amb el ratolí, d'una banda perquè en ser petites no són necessàries grans quantitats i per un altre, perquè existeixen procediments regulats en el ratolí per a mesurar la toxicitat. Posteriorment es realitzen proves amb animals de major grandària.
En aquestes sessions s'analitza l'interval entre la dosi letal i l'efectiva; com més gran és l'interval, més segur és el medicament. A més, s'observen els efectes adversos que es manifesten, tant de manera immediata com a llarg termini, com en generacions futures
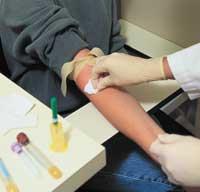
Mesurant la seguretat del fàrmac en l'ésser humà
Quan els resultats de totes les proves anteriors són satisfactoris, cal veure quin efecte té el medicament en l'ésser humà. Per a això es realitzen sessions clíniques i s'analitzen els efectes terapèutics i els efectes adversos. En funció dels resultats, es determina si serveix o no per a la teràpia i, si és vàlid, es determinen les dosis i la posologia (quan i en quants).
Les sessions clíniques es divideixen en quatre fases en funció dels objectius. Els objectius principals d'aquestes quatre fases són, respectivament, l'anàlisi de la seguretat, el mesurament de l'eficiència, la comparació amb altres medicaments i el seguiment i aprofundiment en les recerques una vegada comercialitzades.
En una primera fase, per tant, s'ha de demostrar que el medicament és segur. La importància d'aquesta fase és enorme, ja que fins llavors aquesta substància mai ha estat provada en humans. I si els resultats no són bons, la recerca se suspèn immediatament. Les proves es realitzen amb voluntaris sans i cal destacar que són conscients del que pot causar aquest medicament i que poden abandonar-lo quan ho desitgin.
En els inicis de les sessions clíniques el més difícil és decidir quina dosi utilitzar. El punt de partida són els experiments amb animals, amb una dosi inicial del 1-2% de l'efectiu en els animals i una dosi màxima del 10-16% del màxim permès pels animals. En els primers estudis s'administra una única dosi, i després de veure el que ocorre es decideix si donar la següent o no. A poc a poc la dosi augmenta fins que es detecten efectes inacceptables.
Amb el menor nombre de participants possible (30-100) es pretén obtenir la màxima informació possible. Per a veure com el cos presa la medicació, es mesuren les constants vitals i l'activitat cardíaca i es realitzen anàlisi de sang i orina. Posteriorment es realitzen estudis farmacodinámicas (medicaments i els seus efectes sobre el cos) i farmacocinètics (com afecta el metabolisme del cos al fàrmac) i s'observa la seva interacció amb altres aliments i/o fàrmacs. Tot això demostra si és segur o no. Les proves també serveixen per a decidir quan i com administrar-les.
Unitat de Desenvolupament Farmacèutic de Vitòria-Gasteiz

El treball iniciat en la Facultat de Química de Sant Sebastià podria continuar en la Facultat de Farmàcia de Vitòria-Gasteiz. En concret, dins de la Fundació LEIA, la Unitat de Desenvolupament Farmacèutic està formada pel Departament de Farmàcia i Tecnologia Farmacèutica i la Unitat d'Assajos Clínics de l'Hospital de Txagorritxu.
En la Facultat de Farmàcia estudien les molècules candidates i defineixen les seves característiques. Si veuen que una molècula és vàlida, preparen el medicament. Posteriorment, en la Unitat d'Assajos Clínics de l'Hospital de Txagorritxu es realitzen sessions amb voluntaris de la primera fase. Les anàlisis de sang i orina que s'han de realitzar també es realitzen en aquesta secció de Farmàcia. Si tot va bé passen a la segona fase de les sessions clíniques, però per a això necessiten la col·laboració d'altres hospitals.
A més, a Vitòria-Gasteiz es preparen i proven els medicaments genèrics, alguns dels quals es comercialitzen a través del laboratori Litaphar d'Azpeitia.
Segur sí, però... és eficaç?

En una segona fase s'analitza la curació del medicament. Fins llavors només s'ha mirat a la seguretat, però la no afecció no significa que es beneficiï. En una segona fase es realitzen proves per a comprovar el possible efecte beneficiós i determinar les normes i dosis més adequades per a l'administració del medicament.
La segona fase dura entre un i tres anys i requereix la participació d'entre 100 i 400 persones, algunes d'elles pacients. Finalment es coneix la relació dosi-efecte. En les sessions sempre hi ha un grup de control i els exàmens solen ser aleatoris i cecs, és a dir, el participant no sap si està prenent el medicament o el placebo. A vegades es realitzen sessions dobles cegues, és a dir, l'investigador que dóna la medicina als participants tampoc sap el que està prenent. D'aquesta manera, els resultats són més objectius.
Última fase pre-comercial
La tercera fase recull les últimes proves realitzades abans de la comercialització del medicament. En aquesta fase es compara el medicament amb altres medicaments ja existents en el mercat i d'igual ús terapèutic. A més, els exàmens es realitzen com si els pacients estiguessin en situació normal, és a dir, han de prendre la dosi en la mateixa hora i en el mateix estat en què haurien de prendre la medicació, seguir amb l'activitat normal i el menjar...

Cal no oblidar que el medicament està dirigit a pacients. Per això, els voluntaris de la tercera fase han de substituir tan bé com sigui possible als pacients que rebran el medicament. No obstant això, no sempre és fàcil, ja que la realització de proves amb malalts, vulnerables, nens, ancians i embarassades genera problemes ètics.
Aquests equips són més vulnerables que la resta, per la qual cosa alguns investigadors els exclouen de les proves. La sobreprotecció, no obstant això, no sol ser beneficiosa perquè la població exclosa en els assajos, si algun dia necessita aquest medicament, ningú sabrà quin serà el seu efecte.
Al marge d'això, cal tenir molt clar què es vol aconseguir en la tercera fase, quant temps i quants diners es vol gastar. De fet, molts nous medicaments són més eficaços que els existents, però cal veure fins a quin punt la diferència és tan gran que moltes vegades no és molt gran. En aquests casos, potser és millor suspendre la recerca, ja que la diferència no mereix tants diners i temps.
Després de l'acomiadament cal continuar investigant

Amb tota la informació recopilada en les tres primeres fases de les sessions clíniques, s'elaboren els informes de sol·licitud d'autorització de comercialització. Tenint en compte on es vol comercialitzar, els informes s'envien a l'Agència Espanyola del Medicament, a l'Agència Europea o a l'Administració d'Aliments i Medicaments (FDA) dels EUA perquè, després d'una anàlisi exhaustiva, autoritzin o deneguin l'acomiadament.
Però a l'hora de decidir, moltes vegades passa molt temps, ja que sovint demanen que es completin les dades o que es facin més proves. Segons Brega Larrañaga, directora tècnica del laboratori Litaphar d'Azpeitia, en el cas dels medicaments genèrics aquest procés dura aproximadament un any. Lògicament, quan el medicament és completament nou, el procés d'obtenció de l'autorització s'allarga molt.
Una vegada autoritzat, el medicament surt al mercat. És llavors quan comença la quarta fase de les sessions clíniques. L'objectiu d'aquesta fase és el seguiment de l'eficàcia i seguretat del medicament. Bastantes vegades ocorre, per exemple, que les dosis establertes són massa altes, per la qual cosa es torna a publicar amb dosis més baixes. En menor mesura, poden aparèixer efectes secundaris greus en algun grup de la població que no van ser detectats en sessions clíniques. Això pot obligar a retirar el medicament del mercat.
Altres vegades, gràcies als estudis que es realitzen en aquesta fase, es troben nous usos. Per exemple, l'aspirina porta 105 anys en el mercat. Al principi va sortir per a eliminar el dolor i tractar les inflamacions, però ara se sap que també és beneficiós per a prevenir els infarts i s'estan realitzant proves per a utilitzar-lo en la lluita contra el càncer.
És clar que el llançament d'un nou medicament és un treball penós, llarg i car. A canvi, hi ha remeis contra moltes malalties. No obstant això, a vegades s'abusa de la medicació i la presa de mesura depèn del metge i de cadascun.
El futur comença avui
XX. La farmacologia del segle XX va avançar molt gràcies a la química, la farmacologia i la clínica. A partir d'ara, els experts creuen que els avanços se centraran en la biologia molecular, el genoma i la proteoma, la biotecnologia, la química combinatòria, la bioinformática i la robòtica.

Sens dubte, la identificació dels gens ha suposat una nova manera d'entendre les malalties. Coneixent el control genètic de les funcions de la cèl·lula, s'obren noves vies per a prevenir o curar malalties. Independentment de la teràpia gènica, el coneixement del genoma porta a descobrir les destinacions dels nous medicaments. Proteòmica, per part seva, analitza el producte del genoma, per la qual cosa complementa a l'anterior.
D'altra banda, existeixen diferències entre els grups ètnics a l'hora de metabolizar els medicaments, i és possible que un medicament que beneficia a la majoria pugui causar danys a alguns. La farmacogenética estudia la relació entre el genotip individual i la capacitat de metabolización dels medicaments.
La química combinatòria ha suposat un gran avanç en la química de síntesi. La tecnologia actual permet obtenir molècules d'interès més ràpid que mai. Per a conèixer quins d'aquestes molècules són realment de valor terapèutic s'utilitzen mètodes ràpids de garbellat d'alta eficàcia. Així, es coneixen amb precisió i rigor els distintius d'entre 50.000 i 60.000 molècules a la setmana. Tot això es deu a la bioinformática com a eina imprescindible per a la ràpida comprensió i tractament de tantes dades.

No obstant això, no han d'evitar-se les substàncies naturals amb capacitat curativa. Fins al moment només s'ha explotat el 10% dels recursos de la Terra, per la qual cosa encara queden molts tresors ocults. Per a ser conscients de la seva importància, n'hi ha prou amb veure quins són els medicaments més venuts, com la ciclosporina, la lobastatina, la claritromicina, la pravatatina i l'altobastatina, nou dels deu medicaments no proteics que més es van vendre any passat als EUA

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia