Enfermedad cardiovascular: fisiopatología y nuevos tratamientos
2020/07/16 Shifa Jebari Benslaiman - DoktoregaiaBiokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC) | Asier Benito Vicente - IkertzaileaBiokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC) | Unai Galicia García - DoktoregaiaBiofisika Bizkaia Fundazioa eta Biofisika Institutua (EHU-CSIC) | Asier Larrea Sebal - DoktoregaiaBiofisika Bizkaia Fundazioa eta Biofisika Institutua (EHU-CSIC) | César Martín Plágaro - Irakaslea eta ikertzaileaBiokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC) Iturria: Elhuyar aldizkaria
Las enfermedades cardiovasculares son un conjunto de trastornos cardiovasculares que tienen como causa principal una patología denominada aterosclerosis que se desarrolla por acumulación de colesterol en las arterias. En esta revisión se describe la fisiopatología de la aterosclerosis y los nuevos tratamientos propuestos.
Las enfermedades cardiovasculares (GKBs) son el conjunto de enfermedades que más muertes generan. Cada año mueren 17,9 millones de personas, principalmente por infartos y infartos1. Además, a diferencia de lo que habitualmente se cree, la incidencia de GKB no es sólo una característica propia de los países de renta alta.
Entre los factores de riesgo se encuentran factores genéticos o dependientes de la edad como la hipertensión, altos niveles de colesterol y glucosa en sangre y el sobrepeso. Por otro lado, los hábitos de comportamiento que están en nuestras manos: una dieta insana, un consumo nocivo de tabaco y alcohol y unas actividades físicas inadecuadas. De hecho, la mayoría de los infartos y del corazón se pueden evitar mejorando los hábitos de vida y, por supuesto, recibiendo un tratamiento adecuado cuando sea necesario.
Por último, la situación económica personal y el grado de desarrollo del país de residencia tienen mucho que ver tanto en la detección como en el tratamiento de enfermedades. Por ello, actualmente, más de tres de cada cuatro pacientes con GKB son diagnosticados en países subdesarrollados, según la Organización Mundial de la Salud1.
¿Cómo se producen los infartos?
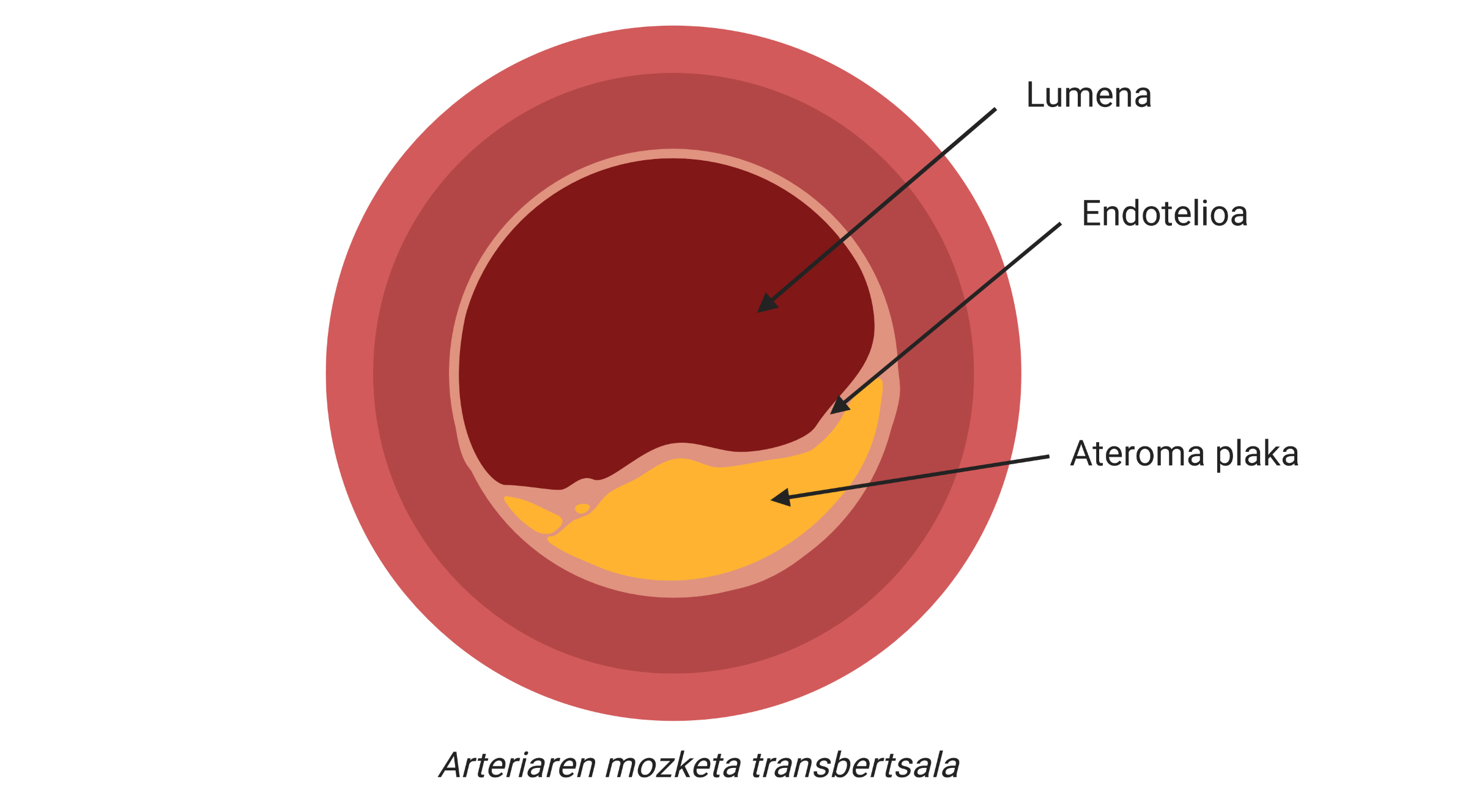
Los infartos y los infartos son complicaciones clínicas de la aterosclerosis, una de las principales causas de enfermedades cardiovasculares, caracterizada por la acumulación de colesterol y elementos fibrosos en las arterias principales.
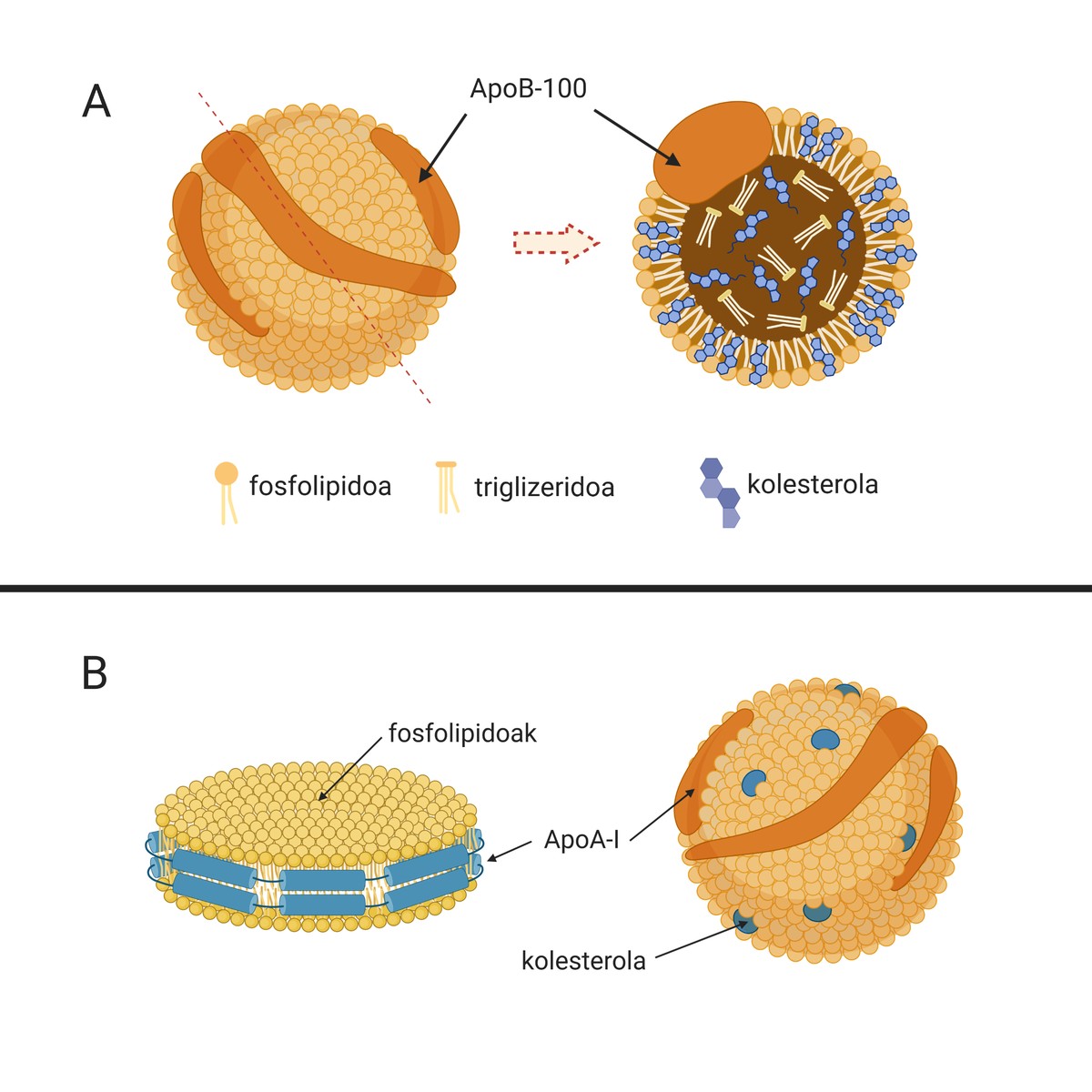
Las causas de esta enfermedad son las lipoproteínas de baja densidad o partículas naturales llamadas LDL (del inglés Low Density Lipoprotein), conocidas como “colesterol malo”. Estas partículas (A.1. La imagen está compuesta por lípidos y apolipoproteínas que se encargan del transporte del colesterol desde el hígado (órgano encargado de la síntesis de la mayor parte del colesterol endógeno) a otros tejidos para su suministro. De hecho, el colesterol es una molécula imprescindible para muchos procesos celulares. Pero si esto es así, ¿por qué tiene el sobrenombre de “colesterol malo”?
Las partículas LDL son capaces de atravesar el endotelio de las arterias corporales y de almacenarlo bajo él, lo que puede ser perjudicial, sobre todo en personas con un alto grado de LDL en sangre (por ejemplo, en pacientes con hipercolesterolemia).
De hecho, una vez que las LDL se encuentran dentro de la arteria, comienzan a oxidarse convirtiéndose en LDL oxidado (LDL ox), ya que no hay antioxidantes presentes en la sangre (Figura 2). En consecuencia, los macrófagos, las células encargadas de la limpieza de nuestro cuerpo, interiorizarán las partículas LDL por medio de receptores, ya que detectan que son nocivas para el organismo, es decir, se encargarán de su eliminación. Si la acumulación de LDL es demasiado elevada, los macrófagos seguirán interiorizándose incontroladamente a través de mecanismos no regulatorios y las gotas de colesterol se irán acumulando en su interior. Ante una situación incontrolable, atraerán a otro tipo de células y se pondrán en marcha mecanismos inflamatorios en los que se empezará a desarrollar la aterosclerosis (Figura 2).
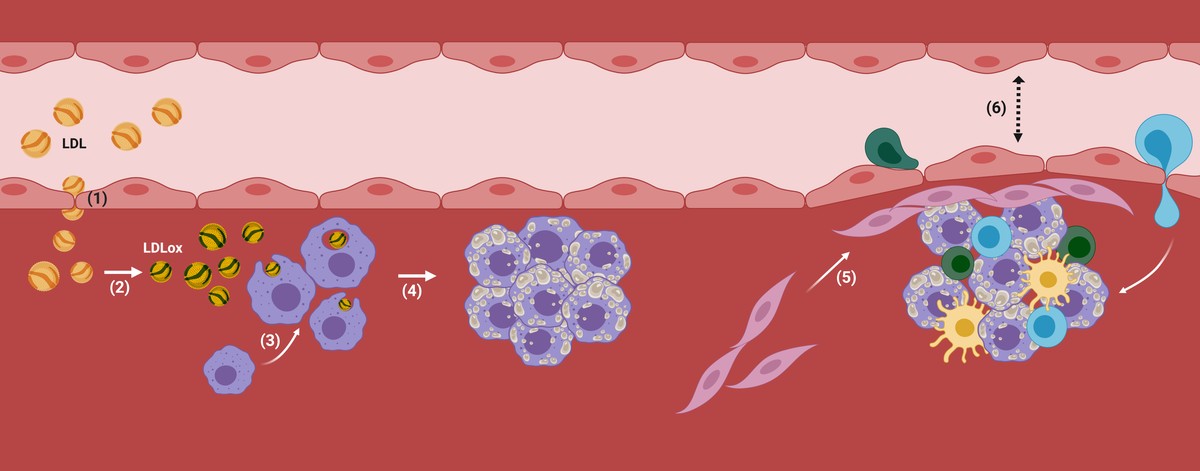
De este modo, se acumularán más colesterol y ciertos tipos de células en la zona subdotelial de la arteria. Además, se comenzará a recubrir la placa con un material rígido producido por las células para evitar que la lesión producida se vierta a la corriente sanguínea. Con el paso del tiempo, esta zona de la arteria será cada vez más ancha y por tanto, el diámetro del vaso sanguíneo será más estrecho. Ahí está la placa aterosclerótica (figura 2).
Hay que decir que en situaciones fisiológicas se puede evitar el desarrollo de esta placa, ya que nuestro organismo dispone de mecanismos para evitar su desarrollo. Entre ellas se encuentran lipoproteínas de alta densidad o partículas lipídicas llamadas HDL (del inglés High Density Lipoprotein) (1.B.). Imagen). También son partículas naturales que se encargan del transporte del colesterol, pero en este caso llevan a cabo un proceso contra las LDL: recogen el colesterol sobrante de los tejidos periféricos y lo llevan al hígado para su excreción. Este proceso se denomina transporte inverso al colesterol. Sin embargo, posteriormente profundizaremos en la importancia de los HDL en la aterosclerosis.
La verdadera complicación clínica puede producirse cuando una parte de la placa ateroma es desestabilizada y liberada, ya que se forma un trombo o coágulo. Esto se debe a que el trombo puede bloquear un vaso sanguíneo, por lo que el tejido que rodea el vaso empezará a morir por falta de oxígeno. Así, llamamos infarto a la muerte de este tejido y, si ocurre en el corazón, al infarto.
Todavía no existe ningún fármaco que trate directamente la aterosclerosis, es decir, que implique la reducción de la placa de ateroma. Por ello, el tratamiento de la enfermedad se basa en la reducción de los niveles de LDL en sangre, utilizando para ello estátinas tan conocidas, con el fin de prevenir más que el tratamiento de la aterosclerosis.
Por otro lado, a las personas diagnosticadas de aterosclerosis se les realiza un seguimiento de la placa y cuando pueden suponer un riesgo para el paciente se suelen retirar con métodos invasivos. Uno de estos métodos invasivos es la endarterectomía, que consiste en la extirpación de la placa de ateroma a través de una intervención quirúrgica.
¿Pero existe la posibilidad de eliminar la placa de ateroma?
Desde hace varios años se está investigando en fármacos que tienen como objetivo frenar el desarrollo de la aterosclerosis y eliminar la placa ateroma, hasta los que se han llevado a ensayos clínicos tan diversos como los procesos que intervienen en el desarrollo de la aterosclerosión3. Sin embargo, su grado de éxito demuestra que todavía no se ha encontrado la clave para tratar la aterosclerosis.
Entre otros, se han propuesto en varias ocasiones fármacos que evitan la oxidación de las LDL, pero, aunque funcionen en laboratorio, nunca se han obtenido resultados significativos en pacientes. Las vitaminas de función antioxidante (vitaminas C, D y E) también han sido testadas en grandes ensayos clínicos, sin mejores resultados.
Por otro lado, se han realizado ensayos que reducen la inflamación. Por ejemplo, el ensayo clínico denominado CANTOS, finalizado en 2017, demostró su eficacia en pacientes con síndrome coronario agudo. En este ensayo se utilizó un anticuerpo llamado canakinumab, que reduce la inflamación y con él los episodios cardiovasculares. Sin embargo, la incidencia de infecciones mortales fue mayor en el grupo tratado con canaquinumab en comparación con el grupo de placebos, y hubo que descartar el tratamiento.
Últimamente se ha propuesto también inmunoterapia, como la utilización de moléculas naturales que estimulan la protección del sistema inmunitario. Por ejemplo, en el ensayo clínico LILAC actualmente en marcha se ha propuesto la administración de bajas dosis de interleucina IL-2 con el fin de inducir la estabilidad de la placa ateroma.
HDL como nuevo tratamiento de la aterosclerosis
Como ya se ha mencionado anteriormente, para hacer frente al desarrollo de la placa de ateroma, existen unas partículas naturales llamadas HDL, responsables del transporte inverso del colesterol. De hecho, los HDL recogen del tejido corporal (y también de la placa) el colesterol sobrante y lo transportan al hígado para que sea eliminado junto con la bilis. De ahí que las HDL se denominen “colesterol bueno”.
Al igual que las LDL, las HDL son capaces de atravesar la pared arterial (ya que son mucho más pequeñas en tamaño) y cumplir su función (3.A. Imagen), recogen el colesterol de los macrófagos que empiezan a acumularse dentro de la arteria. Para ello, la apolipoproteína apoA-I presente en los HDL interacciona con los receptores de la membrana celular de los macrofagos, que, funcionando como canal, pasarán al HDL un colesterol sobrante (3.B. Imagen). Posteriormente, llenas de colesterol, las partículas HDL volverán a la corriente sanguínea hasta el hígado.
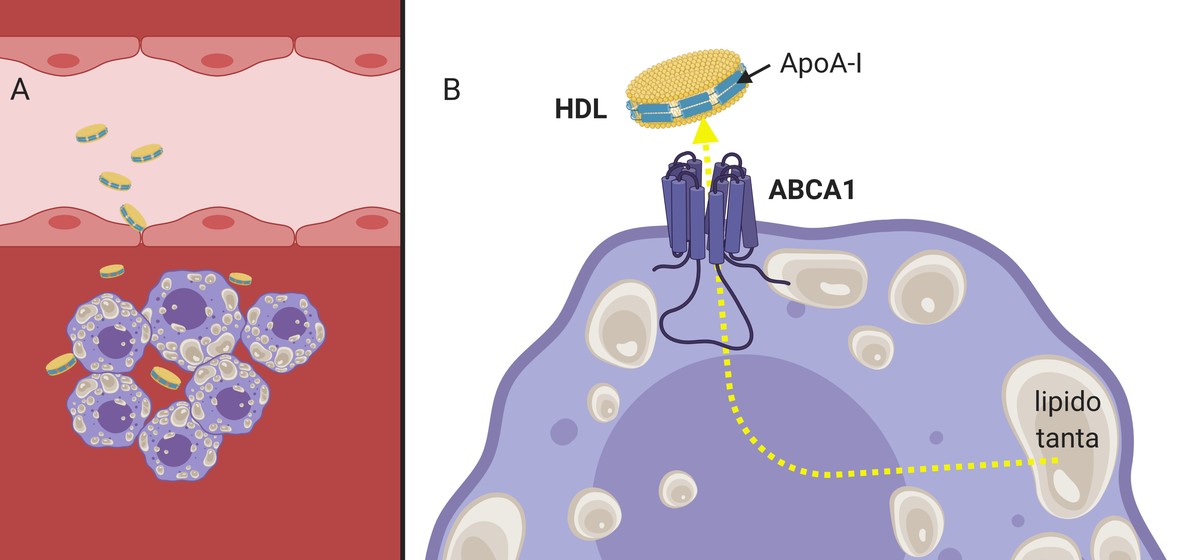
Se ha demostrado que, además de inducir el eflujo o flujo hacia el exterior del colesterol, los HDL son capaces de reducir las señales inflamatorias en la placa ateroma3. Por todas estas características se considera que las partículas HDL son protectoras de saco. No es extraño, por tanto, que muchos grupos de investigación hayan sintetizado en el laboratorio HDL con el objetivo de inducir la eliminación del colesterol.
Las primeras partículas in vitro HDL se formaron en los años 70 y 80; las rHDL a partir de ahora (reconsituted HDL). Para su síntesis se emplearon la principal proteína de HDL, apoA-I y varias mezclas de lípidos4. De esta forma, se obtuvieron partículas discoidales a nanoescala que tenían la misma apariencia que los HDL naturales. Desde entonces se han publicado numerosas combinaciones de RHDL y se ha medido su funcionalidad mediante la capacidad de tomar colesterol de las células de la placa de ateroma. Han tenido un éxito excelente 5,6.
De los estudios in vitro, se pasó a los estudios in vivo mediante ensayos clínicos, los primeros rHDL que fueron probados en humanos, los ensayos clínicos denominados MILANO-PILOT, que finalizaron en 2016. Durante este ensayo, una vez a la semana se suministró a los pacientes una determinada cantidad de estas nanopartículas mediante inyección intravenosa. Sin embargo, no obtuvieron resultados significativos en la reducción de la placa de ateroma y tuvieron que suspender el ensayo clínico.
Posteriormente se han realizado otros intentos, y en un ensayo clínico en marcha actualmente se está probando una nueva composición lipídica de rHDL, con la que se espera que aumente la eficiencia. Para conocer sus resultados hay que esperar al año que viene.
Cabe destacar que se están realizando interesantes ensayos para la utilización de partículas rHDL en el tratamiento del cancer. En estos casos, sin embargo, los rHDL se utilizan como sistema de transporte de fármacos contra el cáncer, ya que el compuesto activo se incluye dentro de la nanopartícula. Con esta formulación se espera minimizar los efectos secundarios tan graves en quimioterapia, ya que han demostrado que los RHDL tienen especificidad tumoral. Es decir, mediante el transporte del fármaco en la nanopartícula se reduciría la liberación de plasma y, por tanto, se reducirían los efectos adversos sobre otros tejidos. Además, al tratarse de un tratamiento corregido, se pueden utilizar dosis inferiores a las normales, obteniendo el mismo efecto contra el cáncer.
Sin embargo, en las enfermedades cardiovasculares, el uso de rHDL aún no se ha extendido a ensayos clínicos. Existen estudios in vitro en los que se prueban formulaciones rHDL que transportan estatinas, pero de momento no se ha propuesto ninguna prueba clínica. Y viendo que hasta ahora los ensayos para inducir el eflujo del colesterol no han conseguido resultados esperanzados12–14, sería interesante llevar a cabo esta propuesta.
BIBLIOGRAFÍA
1.World Health Organization. https://www.who.int/health-topics/cardiovascular-diseases
2.Linton, M. F. et al. The Role of Lipids and Lipoproteins in Atherosclerosis. Endotext (eds. Feingold, K. R. et al.) (MDT ext.com, Inc., 2000), South Dartmouth (MA).
3.Navab, M., Reddy, S. T., Van Lenten, B. J. y Fogelman, A. M. 2011. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat. Rev. Cardiol. 8, 222–232.
4ºMatz, C. E. y Jonas, A. 1982. "Micellar complexes of human apolipoprotein A-I with phosphatidylcholines and cholesterprepared from cholate-lipid dispersions". J. Biol. Chem. 257, 4535–4540.
5.Tang, J. et al. 2016 "Inmune cell screening of a nanoparticle library improves atherosclerosis therapy". Proc. Natl. Acad. Sci. 113, E6731–E6740.
6ºCukier, A. M. O. et al. 2017 "Structure-function relationships in reconstituted HDL: Focus on antioxidative activity and cholesterefflux capacity". Biochim. Biophys. Acta Mol Cell Biol. Lipids 1862, 890–900.
7.Gibson, C. M. et al. 2019. "The CSL112-2001 trial: Safety and tolerability of multiple doses of CSL112 (apolipoprotein A-I [human]), an intravenous formulation of plasma-derived apolipoprotein A-I, among subjects with moderate renal imanes after acute myocardial infarction". Am. J. Heart 208, 81–90.
8º. Sabnis, N., Pratap, S., Akopova, I., Bowman, P. W. y Lacko, A. G. 2013 Pre-Clinical Evaluation of rHDL Encapsulated Retinoids for the Treatment of Neuroblastoma. Front. Pediatría. 1º, 6º
9.Morin, E. R. Li, X. y Schwendeman, A. 2018. "HDL in Endocrine Carcinomas: Biomarker, Drug Carrier, and Potential Therapeutic". Front. Endocrinol. 9, 715.
10. Raut, S. et al. 2018. "Reconstituted HDL: Drug Delivery Platform for Overcoming Biological Barriers to Cancer Therapy". Front. Pharmacol. 9, 1154.
11.Duivenvoorden, R. et al. 2014 "A statin-loaded reconstituted high-density lipoprotein nanoparticle inhibits atherosclerotic plaque inflammation". Nat. Comun. 5, 3065.
12. Nicholls, S. J. et al. 2018. "Effect of Infusion of High-Density Lipoprotein Mimetic Containing Recombinant Apolipoprotein A-I Milano on Coronary Disease in Patients With an Acute Coronary Syndrome in the MILANO-PILOT Trial: A Randomized Clinical Trial". JAMA Cardiol. 3, 806-814.
13. Nicholls, S. J. et al. 2018. "Effect of Serial Infusions of CER-001, a Pre-b High-Density Lipoprotein Mimetic, on Coronary Atherosclerosis in Patients Following Acute Coronary Syndromes in the CER-001 Atherosclerosis Neacute Regression Tracense: A Randomized Clinical Trial". JAMA Cardiol. 3, 815.
14.Tardif, J.-C. et al. 2007 "Effects of Reconstituted High-Density Lipoprotein Infusions on Coronary Atherosclerosis". JAMA Cardiol. 297, 1675.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia





