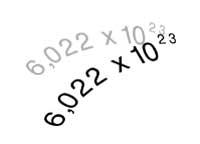Física XIX. En el segle XVIII (I1)
1999/01/01 Bandres Unanue, Luis Iturria: Elhuyar aldizkaria
Teoria atòmica

La teoria atòmica està vigent d'alguna manera des dels antics grecs. Leucip i Demòcrit van ser els primers atomistes, però Aristòtil va ser el rival d'aquesta teoria i si tenim en compte la seva influència en els temps, no és d'estranyar que aquesta hipòtesi va estar radicalment relegada tant en l'Antiguitat com en l'Edat mitjana. El Renaixement va permetre donar a conèixer aquestes idees. Galileu agradava dels àtoms i Newton i Boyle els van considerar en els seus raonaments físics i químics. No obstant això, després es van tornar a relegar, encara que van quedar com a ressò en el pensament científic.
XIX. A principis del segle XX alguns científics van recórrer de nou a aquesta teoria per a expressar certes peculiaritats físiques, els tres estats de la matèria i els resultats quantitatius d'algunes combinacions químiques.
Després de prescindir de la teoria del flogisto, va quedar clar que la matèria tenia tres estats: sòlid, líquid i gasós. Cada substància apareix en alguna d'aquestes situacions, però si les condicions ho permeten pot aparèixer en qualsevol de les tres. L'aigua, per exemple, malgrat aparèixer generalment en estat líquid, també pot aparèixer en forma de gel o de vapor.
D'altra banda, també van començar a investigar les lleis de les reaccions químiques. Es feia principalment amb gasos, ja que era més fàcil que en altres situacions. Per a llavors els gasos ja havien perdut el seu aspecte misteriós i espiritual antic i s'estudiaven com qualsevol altre cos.
Després de diversos estudis realitzats amb les precisions que va permetre la conjuntura de l'època, alguns (contra els prestigiosos científics Lavoisier, Prout, Richter i Berthollet) van demostrar que les parts sempre entren en la mateixa quantitat a l'hora de formar qualsevol compost químic. Aquesta constant de composició va ser molt important en el desenvolupament de la nova química.

Així, se sap que l'aigua, provinent de qualsevol font o procedència, està sempre formada per hidrogen i oxigen i que el pes d'aquests components està en proporció 1/8. D'aquí va sorgir la idea de pes de combinació; si considerem com a unitat el pes de l'hidrogen, el pes de combinació de l'oxigen serà zortziko.
En aquella època es va incorporar John Dalton (1766-1844). Era mestre d'escola i en el seu temps lliure se submergia en matemàtiques, química i física. Després d'aconseguir el lloc de treball a Manchester, va començar a investigar amb gasos i va veure que la teoria dels àtoms era la més adequada per a expressar les peculiaritats dels gasos. Posteriorment, aquestes mateixes idees les va emprar en química i va demostrar que les combinacions podien expressar-se mitjançant sumes de fraccions amb pes específic dels elements. En el seu New Systems of Chemical Philosophy, publicat en 1808, va dir:
"En tots els meus estudis sobre síntesi química, la guia es basa en les següents normes generals:
- Quan per mitjà de dos cossos només tenim una combinació i no hi ha cap raó, hem de pensar que és una combinació binària.
- Quan apareixen dues combinacions hem de pensar que són binàries i ternàries.
- Quan s'obtenen tres combinacions, la una binària i les altres dues són ternàries.
L'aplicació d'aquestes normes als fenòmens químics provats fins al moment pot arribar a les següents conclusions:
- Que l'aigua és un compost binari d'hidrogen i oxigen i que els pesos relatius dels dos àtoms elementals apareixen aproximadament en la relació 1/7.
- A causa de l'hidrogen i al compost binari del nitrogen, els pesos relatius de tots dos àtoms es troben en una relació aproximada de 1/5.
- El gas nitrós és un compost binari de nitrogen i oxigen i els seus àtoms pesen entre cinc i set.
- L'òxid carbònic és un compost binari format per un àtom de carboni i dos d'oxigen que pesa dotze; l'àcid carbònic és un compost ternari (a vegades binari) format per un àtom de carboni i dos d'oxigen, que pesa dinou, etc. En tots aquests casos donem el pes a l'hidrogen, ajustant la unitat de pes als seus àtoms..."
En aquest informe Dalton va cometre alguns errors: els pesos de combinació donats a vegades no són adequats, per exemple quan en lloc de vuit per a l'oxigen amb l'hidrogen dóna set.

Al no tractar més de dos elements en un compost, suposar que la combinació àtom a àtom és binària és un altre error i es va equivocar en aplicar estructures d'aigua i amoníac. No obstant això, Dalton va fer un gran pas en la història de la ciència, convertint el que era una hipòtesi difusa en teoria científica.
Per a representar els àtoms elementals, Dalton va utilitzar punts, asteriscos i creus. El químic suec Berzelius (1779-1848) va refinar aquest mètode i va inventar el que s'utilitza en l'actualitat, és a dir, va expressar el pes relatiu que correspon al seu pes atòmic utilitzant una lletra per a representar un element. Així, "H" no expressa l'hidrogen íntegrament, sinó una unitat de massa d'hidrogen —un gram, un quilogram, o el que es desitgi—, i en el sistema esmentat per "O " representa setzens de la massa de l'àtom d'oxigen.
La major aportació de Berzelius va ser trobar pesos atòmics el més precisos possible o, més ben dit, equivalents de combinació. Va descobrir nous elements, va investigar molts compostos i va fer grans passos en el camp de la mineralogia. Al costat de Davy va investigar les lleis bàsiques de l'electroquímica, començant a destacar la relació entre la química i l'electricitat. Es va avançar massa per a la seva època: pensava que tots els àtoms tenen un tipus o un altre d'electricitat i que aquestes forces elèctriques serien necessàries per a donar combinacions, és a dir, veia en cada compost la suma de dues parts de càrrega elèctrica oposada, així com la influència de les càrregues elèctriques quan es donava una combinació entre els dos compostos.

Aquesta teoria dualista no era molt adequada i aviat va haver de deixar lloc a altres més apropiades. No obstant això, sabem que els fenòmens químics i elèctrics estan estretament relacionats, encara que no tan simples com pensava Berzelius.
Quan es va aprofundir en la recerca dels fenòmens produïts en la combinació de gasos, es va destacar l'escassetat d'idees atòmiques. Gai-Lussac (1778-1850) va comprovar que en combinar els gasos, els seus volums ho fan en relacions senzilles. Avogadro (1776-1856), segons la teoria de Dalton, va concloure que els resultats de Gai-Lussac han de suposar que els volums iguals de tots els gasos han de guardar relacions simples entre el nombre d'àtoms.
Per tot això, és a dir, pels resultats de les combinacions de gasos i de tants assajos físics, es va concloure que era necessari distingir entre l'àtom químic i la molècula física: mentre que el primer seria la part més petita d'una matèria en les combinacions, el segon seria la part més petita en estat lliure. La forma més senzilla d'expressar la hipòtesi d'Avogadro és acceptar que existeixen iguals quantitats de molècules en els mateixos volums de gasos, i així es va suposar.
Tornant al cas de l'aigua, es va observar que combinant dos volums d'hidrogen, i per tant dues molècules, amb un volum d'oxigen, o molècula, s'obtenen dos volums de vapor, o molècules. La forma més senzilla d'expressar-ho és suposant que cada molècula d'hidrogen i oxigen conté dos àtoms químics i que la molècula de vapor d'aigua és H?O, és a dir, 2H2+ O = 2H2O. Per tant, atès que el pes combinat de l'oxigen és zortziko i cada àtom d'oxigen s'associa a dos àtoms d'hidrogen, considerant el pes atòmic de l'hidrogen com a unitat, el pes atòmic de l'oxigen és hexadecimal.

Això obligava a adaptar els pesos combinacionals de Dalton per a obtenir els veritables pesos atòmics dels elements. Això ho va fer per primera vegada de forma totalment sistemàtica Cannizzaro. Així, en reaccionar un àtom d'oxigen amb dos àtoms d'hidrogen, es va observar que aquest tenia d'alguna manera el mateix valor que dos hidrògens, i a aquesta equivalència se'l va denominar "valència", per la qual cosa, prenent l'hidrogen com a unitat, és a dir, reconeixent que és la seva valència, l'oxigen tenia dues valència. Aquest nou concepte de valència va donar lloc a una fructífera collita.
Dalton va comprovar vint elements, després els descobriments van continuar. L'ús de noves vies de recerca en els assajos químics era freqüent trobar nous elements. A causa del corrent galvànic, Davy (1778-1829) va obtenir metalls alcalins de sodi i potassi en 1807. Posteriorment, mitjançant l'anàlisi espectral es van descobrir rubidi, cesi, tal·li i gal·li. La radioactivitat ens ha revelat altres elements com el radi i la seva família, però la majoria d'ells són XX. Són resultats del segle XX.
En 1815, després de Prout, altres investigadors van buscar la relació entre el pes atòmic dels elements i les seves característiques físiques, però va caldre esperar a 1869 per a aconseguir-lo. En aquest any Julius Lothar Meyer i Mendeleiev van ordenar els elements en funció del pes atòmic, la qual cosa va permetre observar la periodicitat dels elements i mostrar una certa afinitat en grups de vuit files, de manera que es podia formar una taula col·locant per columnes elements de similars característiques. Aquesta taula obria el camí per a donar per descomptat els pesos atòmics dubtosos i Mendeleiev va omplir els buits de la taula anunciant alguns elements desconeguts, alguns dels quals després es van trobar realment.
Mendeleiev va considerar que la seva taula era purament empírica. No obstant això, a la vista d'aquestes relacions, va sorgir en alguns l'antiga idea de la base comuna de la matèria. Alguns van pensar que aquesta base podia ser hidrogen i llavors, prenent el seu pes atòmic com a patró, van dir que tots els altres elements requeririen nombres enters, però, encara que en molts casos això es compleix aproximadament, en uns altres no es dóna en absolut. Caldrà esperar mig segle per a trobar aquella base comuna de la matèria i poder donar tots els pesos atòmics amb nombres enters, però aquests assoliments seran el XIX. no accessibles amb mitjans subordinats.
Teoria cinètica de gasos

En 1845 Waterston va enviar a la Royal Society un informe en el qual explicava la teoria cinètica dels gasos i va desenvolupar la mateixa teoria; desgraciadament, aquell informe es va quedar sense estudiar durant anys. No obstant això, després d'observar l'afinitat entre calor i energia, aquesta hipòtesi va aconseguir un gran èxit i Joule la va sucumbir. Per part seva, aquests dos investigadors van calcular la velocitat mitjana del moviment molecular. En 1857 Clausius publica la primera teoria cinètica completa de la matèria.
Es va partir de la hipòtesi que en un gas les molècules es desplacen en totes direccions i que els xocs entre elles eren totalment elàstics. L'energia total de translació de totes les molècules és la mesura del contingut total de calor del gas i l'energia mitjana de cada molècula la mesura de la temperatura. A partir d'aquí, la pressió p es pot calcular matemàticament demostrant que 1/3 nmv2, on n és el nombre de molècules per unitat de volum, la massa de cadascun d'aquests m i el valor mitjà del quadrat de la velocitat v. Així, nm és la massa total de gasos per unitat de volum, és a dir, la seva densitat, per la qual cosa si la temperatura d'un gas és constant v2, la pressió és directament proporcional a la seva densitat i inversament proporcional al seu volum (llei de Charles). Si mantenim dos gasos a la mateixa pressió i temperatura, per l'equació, tots dos tindran el mateix nombre de molècules que les unitats de volum (utilitzant la via química a la qual va arribar Avogadro).

Per tant, la teoria cinètica realitzada per Bernoulli, Joule i Clausius s'ajustava a les característiques detallades dels gasos. D'altra banda, aquesta teoria permet calcular velocitats, com van demostrar Waterston i Joule. En 1865 Loschmidt, basant-se en la teoria cinètica, va poder calcular el nombre de molècules d'un gas en la unitat de volum a la pressió atmosfèrica habitual i zero graus en els Celsius.
Maxwell i Boltzmann van adaptar a la distribució de velocitats la llei de combustió de Gauss basada en la teoria de probabilitats, segons la qual van estudiar la tendència que podia ser la més normal a la velocitat de les molècules i van concloure que es corresponia amb el màxim de la característica anomenada entropia en termodinàmica. La llei de gasos perfectes (pV = RT) era coneguda en aquest segle, però en començar amb els gasos reals s'observaven algunes desviacions. Per a corregir aquestes desviacions, Van der Waals va utilitzar la teoria cinètica i en 1873 va aconseguir la llei que porta el seu nom: (p + a/v2) (v - b) = RT, on les constants per a cada gas a i b són la constant universal R, la pressió p i la velocitat v; aquesta llei va corregir algunes d'aquestes desviacions.
- Robert Boyle. Físic i químic irlandès (1627-1691). Va donar la llei de la compressibilitat dels gasos, va establir el concepte modern d'elements químics i va descobrir la funció de l'oxigen en la combustió.
- Antoine Laurent de Lavoisier. Químic francès (1743-1794). Va ser un dels fundadors de la química moderna. Va inventar la nomenclatura química.
- John Dalton. Físic i químic britànic (1766-1844). És el creador de la teoria atòmica.
- Dmitri Ivanovitx Mendeleiev. Químic rus (1834-1907). Va publicar una taula periòdica d'elements químics (1869) i els intervals que va deixar buits s'han anat completant a mesura que s'han anat descobrint nous elements.
- Joseph Louis Proust. Químic francès (1754-1826). Va ser professor del Real Seminari de Bergara. Va dictar la llei de les proporcions fixes en 1808.
- Ludwig Boltzmann. Físic austríac (1844-1906). Va dictar la teoria cinètica dels gasos i va aplicar les lleis estadístiques.
- James Clerk Maxwell. Físic escocès (1831-1879). A través dels treballs sobre distribució de velocitats de molècules gasoses, va treballar la termodinàmica.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia