Auga: curiosidades dun líquido especial
1987/10/01 Barrenetxea, Tere - Elhuyar Fundazioa Iturria: Elhuyar aldizkaria
Molécula que non cumpre a lei

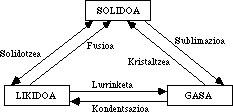
A auga é una combinación dun átomo de osíxeno con dous de hidróxeno: H 2 Ou, só iso. Una fórmula moi sinxela e coñecida, sen dúbida a primeira que aprendemos. Ao tratarse dunha molécula tan simple, parece que si se quere coñecer algo respecto diso bastaría con tomar calquera libro de texto básico sobre química e sacar conclusións del. A súa estrutura non suxire outras particularidades.
O primeiro que sempre se dixo da auga é que é un líquido en estado puro, sen cor, nin cheiro, nin sabor. Pero a partir de aí as propiedades son moi especiais e grazas a esa particularidade a vida no noso planeta.
Cando Celsius inventou o termómetro, baseouse en dúas propiedades: a temperatura de ebulición da auga e a temperatura de conxelación. O primeiro deles coincidiu con 100°C e o segundo con 0°C. Dividiu o espazo en cen partes iguais, cada una cun grao. Así naceu o primeiro instrumento paira medir a temperatura. Celsius non sabía, con todo, que estas dúas propiedades non son normais na auga en termos de magnitude. Os científicos saben que o punto de ebulición dun líquido ten que ver co tamaño da molécula. É dicir, canto máis pequenas son as moléculas, menor é o punto de ebulición.
Isto supón que a auga, comparada con outras moléculas do seu tamaño, ten una temperatura de ebulición moi superior á que correspondería.
Este punto pode ser analizado desde outro punto e a conclusión é similar. Sábese que as propiedades dos compostos derivados de elementos do mesmo grupo da Táboa Periódica non son de calquera tipo, senón que poden ser predicibles en función da súa posición na Táboa.
O osíxeno pertence ao mesmo grupo que o xofre, o selenio, o teluro e o polonio e a auga, o hidruro de osíxeno, ten a mesma fórmula que os hidruros dos elementos deste grupo: H 2 S, H 2 Se, H 2 Che, H 2 Po. A temperatura de ebulición de todos estes compostos é coñecida e vai aumentando regularmente desde o hidruro da sufera até o polonio, que é máis pesado.
Con todo, a auga non fixo caso a esta regularidade e ten una temperatura de ebulición moi superior á correspondente. Grazas a iso, a auga é líquida a temperaturas normais e non gas, como o resto dos hidruros desta familia.
Algo parecido ocorre coa temperatura de conxelación, que é superior á dos hidruros doutros elementos do grupo, que debería estar preto de -100°C é de 0°C.
A tortuosidad da auga contra as leis do sistema periódico fai que o estado líquido e sólido que presenta a auga no chan sexa anormal, xa que de acordo coas leis debería estar en estado gaseoso.

Outra non normalidade da auga é que o xeo é máis lixeiro que a auga. Por iso os picos de iceberg quedan fóra do ano. A experiencia física sobre este punto é todo o contrario, xa que todas as demais sustancias son máis pesadas en estado sólido (teñen maior densidade) que en estado líquido.
Por iso, se se deposita un anaco sólido do metal nun metal fundido, nunca flotará, afundirase.
Os cambios na densidade da auga coa temperatura tamén son espectaculares. Todas as sustancias dilátanse coa calor e contráense co frío. Pero a auga non se conforma só con ela e ten a súa máxima densidade a 4º C. Se se segue arrefriando por baixo desta temperatura, en contra do que cabería esperar, o seu volume aumenta ata que se conxela. Por iso as botellas rompen cando as deixamos esquecidas no frigorífico.
A botella de vidro ten un comportamento normal, polo que se vai contraendo a medida que se vai arrefriando, pero a auga sempre debe facer o contrario e ao conxelarse aumenta o seu volume. E si non imos rápido, a conclusión é coñecida: a necesidade de pór anacos de vidro no frigorífico e una nova botella refrescando.

Outra consecuencia ecolóxica e moito máis importante desta máxima densidade é a conxelación superficial a fondo de ríos, mares e lagos. Así, a capa superficial de xeo actúa como illante e pode subsistir baixo as augas xeadas.
Cando tras a choiva conxélase a auga que quedou en pequenas franxas rochosas, debido á enorme presión xerada por este aumento do volume do xeo, pode producirse una rotura da roca ou polo menos a formación de gretas.
Outra característica importante da auga é o seu alto poder calorífico, que tamén ten grandes consecuencias ecolóxicas, como o regulador do tempo.
Cando o inverno envíanos os seus primeiros fríos tempos, a auga toma xeo e neve, liberando a gran cantidade de calor que tiña almacenado. Así, os días fríos de inverno non os sentimos bruscos, xa que a temperatura ambiente arrefríase máis lentamente.
E ao revés, ao fundir xeo e neve, adquiren gran cantidade de calor da contorna e os días calorosos sentímolos máis lentamente.
Doutra banda, a presenza de correntes mariñas quentes (como Gulf Stream) tamén ten gran importancia na regulación do tempo. Esta corrente chega desde as terras do tempo tropical até as rexións frías do Ártico e do Antártico, onde a calor vaise liberando. A cantidade de calor que flúe neste problema é realmente incrible. Vexamos as cifras:

A cantidade de enerxía liberada por Gulf Stream ao aire hora é igual á xerada polos ríos de 200 billóns de toneladas de carbón. Esta cantidade de toneladas equivale aproximadamente a 2/3 da produción anual de carbón. Dito doutro xeito, o alto poder calorífico da auga permite que os océanos absorban a enerxía solar e convértana nun enorme depósito de enerxía. Como dixemos, estas xigantescas masas de auga desprázanse lentamente cara a terras frías liberando enerxía calorosa e amornando o tempo paira evitar cambios drásticos.
É certo que nos afixemos a mil cousas que ocorren a diario na natureza e perdemos a capacidade de sorprendernos ante elas e a curiosidade por atopar a súa razón. Podes pensar algunha vez por que hai choiva formada por case pingas redondas? Isto é debido a unha estraña propiedade da auga.
Fóra dalgúns metais líquidos, como o mercurio, e algúns sales fundidos, a tensión superficial da auga é superior á de calquera outra sustancia. A tensión superficial dá a medida da forza que provoca que a auga non se expanda sobre unha superficie e quede en forma de pinga, o mesmo ocorre no aceite e na gasolina.
Se a tensión superficial da auga fose menor, mesmo co menor vento, as augas mariñas mollarían as terras costeiras. Da mesma maneira, as nosas precipitacións e gabardinas farían pouco se a auga tivese pouca tensión superficial, xa que pasaría polo tramo máis pequeno. Con todo, os poucos produtos denominados tensoactivos reducen facilmente a tensión superficial da auga. Debido a esta propiedade que non teñen os outros líquidos, a auga (suor) pode ascender por uns 80 m ou máis en tubos capilares moi estreitos de árbores, situados no alto paira alimentar as follas.
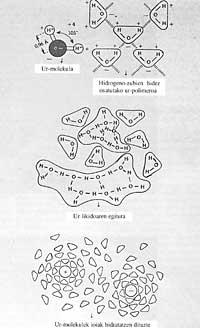
O uso de xabón lavamanos tamén ten a súa razón, o xabón é tensoactivo e si non o usásemos, debido á alta tensión superficial da auga, a auga non chegaría a todas as ranuras, é dicir, non nos mollaría ben as mans.
Auga en procesos de vida
Á luz de todas estas propiedades que estudamos, podemos dicir que a auga non é un líquido moi corrente. E podemos asegurar ademais que é difícil atopar una única propiedade da auga que poida considerarse normal. Este peculiar comportamento ten gran importancia en moitos campos da ciencia e a técnica, pero agora imos pasar por alto o papel da auga na subsistencia da vida no noso planeta.
A auga participa en case todas as reaccións bioquímicas. Vexamos os camiños do corpo humano paira obter enerxía. Todos sabemos, entre outras cousas, que nos alimentamos de hidratos de carbono, que son a fonte de enerxía necesaria paira todas as funcións do corpo. A reacción dos hidratos de carbono na transformación da enerxía é que a combustión da glicosa, polo osíxeno, produce auga e dióxido de carbono.
A cantidade diaria de auga que necesita o corpo humano é de aproximadamente 2,5 l. Esta auga obtémola mediante a comida e a bebida, pero tamén mediante a reacción antes mencionada. A cantidade de auga xerada por persoa e día por esta última vía é de 0,3 l. Deste xeito, se non se renovan os hidratos de carbono e a auga que consumimos as persoas e os animais, esgotaríanse en breve. O equilibrio natural conséguese a través das plantas, que reaccionan igual pero en sentido contrario coa enerxía solar. É dicir, as plantas sintetizan hidratos de carbono a partir do óxido de auga e carbono (IV). O reino vexetal desta sinxela operación require 3 billóns de litros de auga ao día.
A reacción que se estuda require 185 l de osíxeno por persoa e día. Como o osíxeno no aire é só un 21% e a eficiencia dos pulmóns humanos é do 14%, respiramos diariamente 6300 l de aire. Estas cifras non teñen relación co noso tema (a auga), pero nos pareceu conveniente referirnos á nosa contorna e sobre todo á nosa dependencia do traballo das plantas.
Outro aspecto da implicación da auga nos procesos da vida vén ligado á súa capacidade de disolvente. É o medio de transporte de sustancias a través de organismos vivos. Paira iso, a auga debe romper enlácelos entre os átomos ou moléculas do corpo en estado sólido, separándoos do corpo de devanditos átomos ou moléculas para que queden dentro da auga. Debido a esta capacidade, o azucre pode gozar de café con leite ou sal de cociña paira salgar a comida.
Outra consecuencia da capacidade disolvente da auga é que pode actuar como base bioquímica. Acabamos de ver a capacidade da auga como disolvente paira desmontar a estrutura dos corpos e agora estamos a dicir algo que parece contraditorio; que ten o papel de base bioquímica. Aínda que pareza mentira, aí non hai contradicións, porque son aspectos da mesma función. En canto ao primeiro aspecto, a auga mantén en disolución sustancias simples como o azucre ou o sal, pero no segundo, sustancias complexas como as encimas axudan a manter a estrutura.
As encimas son sustancias producidas pola natureza paira poder conducir as reaccións bioquímicas necesarias paira levar a cabo as funcións do corpo. As encimas son proteínas, moléculas xigantes formadas por aminoácidos. As encimas, do mesmo xeito que os colares de perla, poden adoptar moitas formas (espaciais). No caso das encimas, esta disposición espacial é de suma importancia, xa que paira cumprir a súa función ten que ser una disposición espacial moi precisa e diferente de todas as demais encimas.
Os científicos aínda non coñecen ben as forzas que fan posible estas disposicións, pero é seguro que paira esta función a auga é necesaria. Si por calquera motivo modifícase a composición da solución acuosa que rodea á encima, esta perde a súa forma propia e, por tanto, a súa capacidade paira desempeñar a súa función.
Aínda non está claro como a auga mantén a estrutura da proteína actuando como base bioquímica. O que se pode dicir é que as unións auga-proteína son moi débiles e son moi fáciles de perurbar.
O papel da base bioquímica non se limita ao ámbito das encimas. O mesmo ocorre con outras estruturas biolóxicas básicas como o dobre hélice do ADN.
Á luz dos dous aspectos que vimos, a auga como disolvente e base bioquímica, pódese pensar que o papel da auga na bioloxía é estático. Pero, claro, isto non é así: a auga, como fluído biolóxico, transporta as sustancias necesarias paira a vida (alimentos, osíxeno) aos lugares necesarios e á vez expulsa os residuos xerados polo metabolismo.
Paira ver este comportamento imos dar unhas cifras. Cada latexado cardíaco bombea 70 ml de sangue. Tendo en conta que realiza 70 pulsaciones por minuto, realizamos operacións sinxelas e conseguimos que 7000 l de sangue circule polo noso corpo. Outros órganos, como o ril, tamén deben tratar grandes cantidades de auga.

Habemos visto que a presencia da auga nos seres vivos é importante, pero non todos os seres vivos temos a mesma proporción de auga. Todas as formas da vida e todos os tecidos dun determinado individuo teñen auga, pero en diferentes proporcións. O 60% do peso do corpo humano é auga e o 99,5% da medusa. No noso corpo, o cerebro e os músculos son os que presentan una maior proporción de auga e os ósos os que menos. É coñecido que cada célula necesita una cantidade mínima de auga paira o seu funcionamento, pero non se coñece moito sobre as propiedades da auga na célula.
O seu estado, distribución, funcións e obrigacións e os seus mecanismos de control de saída e entrada seguen sendo descoñecidos. Por iso non sabemos a causa de problemas como o seguinte. O problema é que cando os tecidos conxélanse, o 20% da súa auga nunca se conxela, nin sequera a temperaturas moi baixas. Parece que hai moléculas de auga que quedan protexidas e ocultas e que non poden ocupar un lugar que lles correspondería no cristal de xeo. Esta auga non só aparece nos seres vivos, senón que tamén ocorre algo parecido nos poros microscópicos dos minerais.
E paira terminar, imos ver como se adaptan algúns animais e plantas acuáticas paira vivir no seu interior.
A densidade da auga respecto ao aire é tan alta que calquera corpo na auga é 800 veces máis lixeira que no aire. Como consecuencia, as plantas e animais que habitan na auga non necesitan dun esqueleto tan complexo como os que habitan no chan. Pero non todas son vantaxes. A insolubilidad do osíxeno na auga é limitada, polo que as persoas que viven no medio acuático teñen dificultades respiratorias e tiveron que desenvolver complexos sistemas respiratorios.
É evidente, por tanto, que vivir mergullado na auga ten os seus problemas, pero non son menores os que viven en territorios con escaseza de auga. Os seres vivos que se adaptaron a vivir nestes medios non teñen por iso una menor dependencia da auga. Pola contra, o prezo que tiveron que pagar foi moi caro, xa que tiveron que desenvolver mecanismos moi complexos paira conservar a auga.

A maior parte da auga que hai no noso planeta non é doce, senón salgada, con só o 0,3% da auga doce dispoñible. A maior parte desta auga atópase nos Polos e a outra fonte principal de auga doce é o vapor de auga atmosférica. A cantidade de auga que se evapora anualmente estímase en 450.000 billóns de litros. Paira darnos conta da magnitude desta cantidade, pensade que se esa auga expandísese uniformemente no noso planeta xeraría una capa de auga de 106 cm de altura. O 75% deste vapor volve aos océanos en forma de choiva e parte do resto faio tamén a través dos ríos.
A cantidade de auga na atmosfera é de tan só 12000 billóns de litros. Por tanto, atoparemos que facendo una simple división, a auga da atmosfera recíclase 37 veces ao ano.
Non hai que dicir, pero o imos a dicir, que a medida que aumenta a poboación e o consumo de auga por habitante, e a proporción das frechas de auga deste planeta, que é útil paira nós, non só é un problema científico, senón tamén político e económico.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia