Angiogénesis tumoral
En els últims 30 anys, molts grups de recerca de molts països han dedicat els seus esforços a curar aquesta malaltia. Això sí, encara que és una de les alteracions més estudiades i estudiades des d'un punt de vista biològic i molecular, encara hi ha molts dubtes que resoldre i està a punt de trobar el tractament de molts tipus de càncer. De fet, la diversitat de tipus de càncer fa que el descobriment d'una ‘bala màgica’ o, cosa que és el mateix, el desenvolupament d'un tractament contra tota mena de càncer sigui pràcticament impossible. Per això, els objectius científics es dirigeixen, d'una banda, a la cerca de solucions específiques per a cada tipus de càncer i, per un altre, al desenvolupament de noves estratègies terapèutiques que complementin o substitueixin a les tècniques actuals de cirurgia, quimioteràpia i radioteràpia.
Una d'aquestes noves estratègies contra el càncer és la teràpia contra l'angiogénesis. Aquesta estratègia de creixent importància es basa en la inhibició de la creació de nous vasos sanguinis que alimenten i vesteixen el tumor (Folkman, 1971). En aquest treball, a més d'incidir en la importància de l'angiogénesis en el desenvolupament del càncer, s'analitzaran les possibilitats terapèutiques que ofereixen les seves inhibicions.
Què és l'angiogénesis tumoral?
Els factors que intervenen en la creació i difusió del càncer són nombrosos. Aquests factors, tant hereditaris com epigenètics, modifiquen el material genètic de les cèl·lules, especialment el relatiu a la seva capacitat reproductiva. Per tant, una cèl·lula que abans es dividia de manera controlada i limitada la fa infinita. No obstant això, el creixement del càncer no es deu únicament a la immortalitat cel·lular.
En el càncer de pròstata, per exemple, la fracció de cèl·lules que es divideixen és només un 2% (Berges, 1995), i el 90-99% de les cèl·lules tumorals generades moren per falta de nutrients. Què significa això? Que molts tipus de càncer necessiten d'un nou succés per a mantenir la població cel·lular en desenvolupament. Aquest fenomen és l'angiogénesis.
L'angiogénesis, per tant, és el procés de formació de nous vasos sanguinis a partir dels ja existents. Els nous vasos sanguinis, a més d'alimentar el tumor, permetran la seva metàstasi, és a dir, la seva extensió a les noves parts del cos. Perquè un petit poble es converteixi en ciutat, com les carreteres que comuniquen cases a part de les noves, el càncer necessita, a més de cèl·lules, vasos sanguinis per a alimentar-se, créixer i expandir-se. No obstant això, l'angiogénesis no és només un fenomen relacionat amb el càncer, sinó que també és un procés que es produeix en certes situacions fisiològiques (cicle menstrual i cicatrització) i fisiopatològiques (psoriasis i retinopatia diabètica) (Figura 1).
Inici, fases i efectes de l'angiogénesis tumoral
La formació de nous vasos sanguinis és un reflex de la necessitat de nutrients i oxigen del tumor. Quan apareix aquesta necessitat, les cèl·lules tumorals segreguen substàncies anomenades “factors angiogénicos” o “reguladors positius”. Aquests factors afecten les cèl·lules endotelials dels vasos sanguinis i inicien l'angiogénesis.
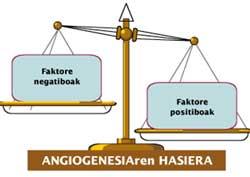
En condicions normals, la concentració d'aquests factors està en equilibri amb la concentració d'uns altres amb efecte advers. Aquestes últimes es denominen ‘antiangiogénicas’ o ‘reguladors negatius’. El càncer, fomentant la concentració relativa de reguladors positius que exciten la formació de nous vasos sanguinis (Figura 2), trenca aquest equilibri.
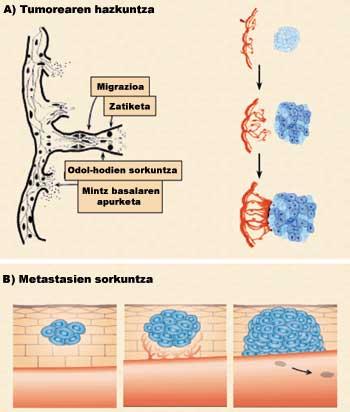
L'angiogénesis es divideix en quatre fases (figura 3). En una primera fase es trenca la membrana basal dels vasos sanguinis ja existents (1a fase: trencament de la membrana basal). Com a conseqüència d'això, les cèl·lules endotelials són expulsades del vas sanguini i disperses a la zona tumoral (2a fase: migració). En aquest camí les cèl·lules van dividint-se (Fase 3: Divisió). Finalment, les cèl·lules s'uneixen entre si a través de diferents proteïnes adhesives formant un nou vas sanguini (Fase 4: unió de cèl·lules).
El desenvolupament d'aquestes quatre etapes té dues conseqüències principals: d'una banda, el creixement tumoral a causa dels nutrients, l'oxigen i els factors estimulants (figura 3.a), i per un altre, la introducció de cèl·lules tumorals en els vasos sanguinis, que per via sanguínia s'estenen a altres parts del cos i provoquen nous tumors (figura 3.b).
Inhibició de l'angiogénesis tumoral
Actualment és coneguda la relació entre la vitalitat de l'angiogénesis tumoral, la freqüència de metàstasi i la reducció de l'esperança de vida dels pacients (Pluda, 1997). Per això, la inhibició efectiva de l'angiogénesis s'ha convertit en l'objectiu de molts científics. Sobretot, evitar la formació de nous vasos sanguinis, ja que a més d'inhibir la metàstasi, reduirà la grandària del tumor, facilitant l'erradicació del càncer mitjançant quimioteràpia o cirurgia.
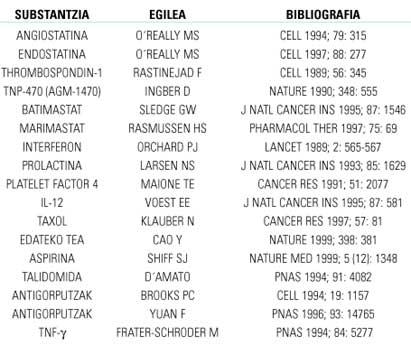
Tenint en compte l'anteriorment exposat, una forma senzilla d'inhibir l'angiogénesis seria dirigir-la cap als equilibris reguladors negatius dels factors. Això es pot aconseguir de dues formes: inhibint els factors positius o fomentant els negatius. També es pot inhibir qualsevol fase de l'angiogénesis si es bloquegen els enzims i/o proteïnes implicades. En la taula 1 es mostren els fàrmacs més eficaços contra l'angiogénesis investigats en animals de laboratori. D'ells, només els que millors resultats i més seguretat ofereixin intentaran en humans amb sessions clíniques.
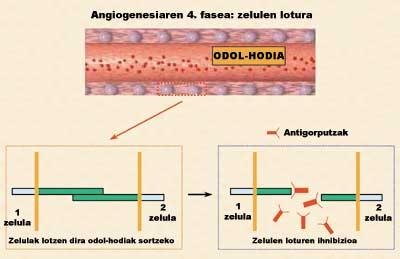
De les quatre fases de l'angiogénesis, una de les més interessants és la que menys s'ha estudiat des d'un punt de vista terapèutic. Per això, el laboratori de Farmàcia i Tecnologia Farmacèutica de la Facultat de Farmàcia (UPV/EHU) va iniciar un nou estudi d'inhibició de l'angiogénesis per a bloquejar aquesta quarta fase. L'objectiu de la recerca va ser inhibir algunes proteïnes adhesives que permeten la unió entre cèl·lules endotelials. Per a inhibir o bloquejar aquestes proteïnes es van utilitzar cèl·lules que segregaven anticossos específics (Figura 4). No obstant això, si les cèl·lules s'administressin com a tals, eliminaria ràpidament els sistemes immunològics dels animals per considerar-los desconeguts.
Per a solucionar aquest problema, els agrupem en esferes polimèriques de petita grandària que protegeix les cèl·lules enfront del sistema immunològic. Aquest procés es coneix com microencapsulación cel·lular (Orive G, 2000). Dins d'aquestes petites càpsules, les cèl·lules, a més de créixer, segregaven l'anticòs que ens interessava. Aquesta nova estratègia anti-angiogénesis té dos avantatges principals: d'una banda, la inhibició d'una proteïna poc estudiada i per un altre, la secreció continuada i prolongada d'anticòs per part de les cèl·lules.
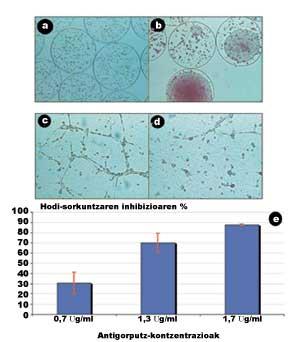
En la figura 5 es presenten alguns dels resultats obtinguts en aquest estudi (Orive G, 2001). En les següents imatges, obtingudes mitjançant el microscopi, s'observa que les cèl·lules creixen i es divideixen ràpidament a l'interior de les càpsules, donant lloc a la formació d'agregats violents (Figures 5.a i 5.b).
En una altra sessió analitzem la capacitat dels anticossos segregats per a bloquejar la unió entre cèl·lules endotelials. Per a això, les cèl·lules endotelials van ser estimulades per factors de creixement. Aquests factors van estirar les cèl·lules i van facilitar les unions entre elles, creant vasos sanguinis immadurs (tubulos), és a dir, estructures prèvies als vasos sanguinis que alimentaran el tumor. Com s'observa en la figura 5.c, en absència d'anticossos, les relacions entre cèl·lules endotelials són molt notables.
Per contra, quan es va introduir la dissolució d'anticossos amb una concentració de 1,7 µg/ml, les unions intercel·lulars i, per tant, la formació de tubulos es van inhibir gairebé per complet (Figura 5.d). Quin és el seu significat? Que l'anticòs que segreguen les cèl·lules encapsulades té la capacitat d'inhibir l'angiogénesis i que el bloqueig de proteïnes adhesives és una bona estratègia per a inhibir l'angiogénesis tumoral. A més, en una última sessió es va demostrar que la relació entre la tracció concertística anticòs i la capacitat d'inhibir l'angiogénesis és directament proporcional (Figura 5.e).
Aquests esperançadors resultats inicials ens han portat a una nova recerca en la qual utilitzarem la teràpia gènica com a base per a inhibir l'angiogénesis tumoral.
Fi
A partir de la dècada dels 90 l'angiogénesis s'ha anat fent cada vegada més interessant tant per als científics com per a la indústria. De fet, més de 25 fàrmacs contra l'angiogénesis estan sent tractats en sessions clíniques (Kerbel, 2000). L'interès actual se centra no sols en el descobriment de nous fàrmacs, sinó també en la combinació d'estratègies antiangiogénesis i estratègies convencionals contra el càncer (quimioteràpia, radioteràpia i cirurgia).
Aquesta última idea té una gran importància tenint en compte que la combinació de diverses estratègies pot predir efectes sinèrgics, és a dir, efectes més beneficiosos que els reeixits individualment per aquestes estratègies. A més, noves estratègies d'administració (anticossos monoclonals, teràpia gènica, etc.). ), permeten noves solucions per a inhibir l'angiogénesis i així controlar els càncers.
En definitiva, encara que encara queda molt per investigar, el treball diari i el somni més dolç de tots els científics és fer seves les males malalties.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











