Organoides, que son e por que están a revolucionar?
O cultivo de células no laboratorio non é unha cuestión nova. Durante décadas, os métodos de cultivo celular bidimensional (2D) foron a base da investigación e a principal ferramenta para o desenvolvemento de novas terapias. Pero... son suficientes para responder os retos da ciencia de hoxe?
En realidade, as súas limitacións foron postas de manifesto polos avances en ciencia. Estes modelos non son capaces de imitar completamente a complexidade dos tecidos do noso corpo. Carecen dalgúns factores necesarios para o noso corpo e función, como a matriz extracelular organizada en 3 dimensións, os sinais bioquímicos específicas ou os estímulos ambientais axeitados [1]. Isto pon límites á investigación e ao desenvolvemento de novos tratamentos porque os procesos que ocorren no corpo non poden ser examinados na súa totalidade. Neste contexto, os modelos tridimensionais (3D) supuxeron un gran avance, xa que conservan as principais características dos órganos e tecidos. Neste novo escenario, os organoides están a destacar cada vez máis como instrumentos prometedores, pero... que son realmente?.
Son estruturas tridimensionais formadas por células que teñen a capacidade de autoorganizarse, é dicir, un conxunto de células capaces de producir un sistema perfectamente unificado. Imaxina algúns miniórganos creados no laboratorio. Replican a pequena escala as principais características funcionais, estruturais e biolóxicas dos órganos reais, achegándose á organización e complexidade funcional do paso do nivel celular aos órganos [2]. Permiten entender o desenvolvemento dos órganos, estudar a orixe das enfermidades, como os cancros ou as enfermidades neurolóxicas, probar a seguridade de novos fármacos ou avanzar no deseño de terapias personalizadas [3]. Ademais, representan o futuro do medicamento rexenerativo e os transplantes, facendo realidade o que hoxe en día é máis próximo á imaxinación.
Como se forma un organoide? Compoñentes clave para o deseño
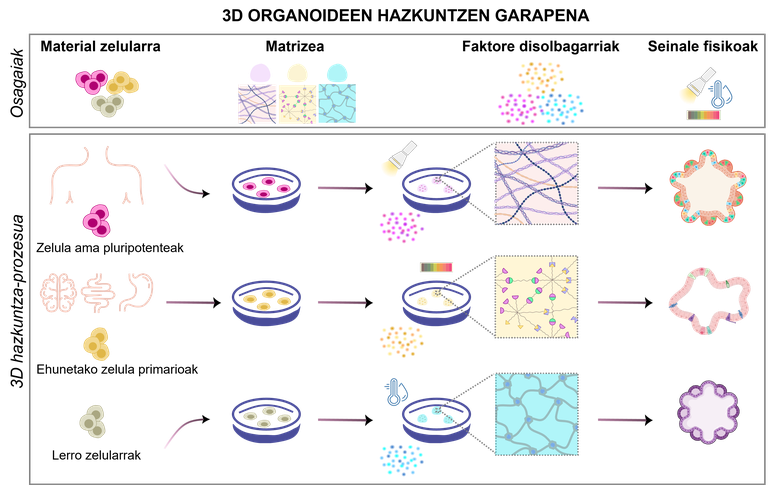
Os organoides son o resultado dun proceso específico que debe deseñarse adecuadamente. Dependendo dos obxectivos do experimento, cambiando os tipos celulares e os compoñentes necesarios, hai varios deseños posibles para responder as necesidades da investigación (Figura 1). Para iso, é fundamental ter en conta este catro compoñentes:
1.Material celular
Dependendo dos obxectivos do experimento, as células xeradoras de organoides pódense seleccionar de diferentes fontes:
· Células nai pluripotentes. Teñen a capacidade de innovar e diferenciar en calquera tipo de células do corpo humano cambiando o medio de crecemento utilizado. Existen dous tipos principais: as células nai embrionarias, obtidas a partir de embriones precoces [4]; e as células nai pluripotentes inducidas (iPSC), producidas por reprogramación de células adultas [5].
· Células primarias illadas dos tecidos orixinais. Íllanse directamente de tecidos fetais ou adultos, mantendo así mellor as propiedades biolóxicas orixinais. As células nai adultas dos tecidos, as células proxenitoras ou as células somáticas separadas pódense illar tanto de tecidos sans como de enfermos [2].
· Liñas celulares. As liñas celulares preestablecidas nos laboratorios poden ser facilmente manipuladas e modificadas xeneticamente para probar medicamentos personalizados ou investigar enfermidades raras [6]. Con todo, estes tipos celulares difiren significativamente do modelo in vivo que se pretende replicar.
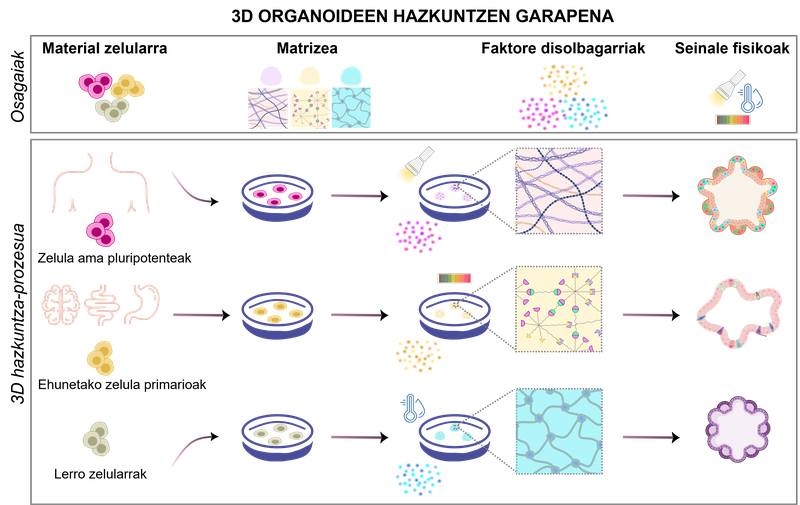
figura 1. desenvolvemento de cultivos de organoides 3D. Dependiendo dos biomateriales e das condicións físico-químicas utilizadas, poden formarse diferentes tipos de organoides.
2.Matrizea: soporte de células
A matriz extracelular proporciona soporte para o crecemento, desenvolvemento e mantemento de organoides mediante sinais mecánicos e bioquímicos. Imita a contorna natural das células, ofrecendo estímulos mecánicos e bioquímicos que inflúen no crecemento, diferenciación e organización das células. Actualmente, as matrices máis utilizadas son os hidrogeles, que son redes poliméricas capaces de reter unha gran cantidade de auga e que poden ter propiedades físico-químicas moi similares ás dos tecidos orixinais [7]. A súa principal vantaxe é a súa adaptabilidad, a rixidez ou porosidad adáptana ás necesidades de cada organoide. Ademais, protexen ás células da tensión externa e permiten o intercambio de nutrientes e osíxeno. Ademais dos hidrogeles, están a estudarse outras alternativas como as microesferas e as estadas porosas [8, 9].
3.Faktore solubles: responsables do mantemento dos organoides
Os factores solubles son un dos compoñentes máis importantes no medio de crecemento dos organoides. Estas moléculas únense aos receptores da superficie celular e activan sinais internos para iniciar ou inhibir certos procesos, como a separación e/ou a proliferación celular.
No cultivo de organoides, estes sinais solubles agréganse no laboratorio, principalmente como proteínas (como os factores de crecemento) ou pequenas moléculas que poden activar os carreiros de sinalización [10, 11]. Pero non basta con saber que se engade, tamén é fundamental saber cando e como se engade. No corpo, os sinais que pon en marcha os procesos están coordinadas no espazo e o tempo. Por exemplo, para o crecemento de células nai humanas pluripotentes e para a formación de organoides formados por diferentes tipos celulares, é especialmente importante esta presentación espazo-temporal [12]. Esta presentación controlada pódese lograr a través de varias estratexias de enxeñaría de tecidos, como encapsular os factores de crecemento dentro das nanopartículas e fixalos na superficie das células para que se liberen de forma controlada. Tamén poden utilizarse algúns métodos baseados na nanotecnoloxía, como a nanoimpresión, a litografía ou a electrodeposición, para xerar superficies similares á membrana basal en cultivos celulares 3D [13-15]. Mediante estes métodos, as moléculas de sinalización quedan atrapadas na membrana basal e liberadas de forma controlada.
4.Seinale físicas: o movemento tamén importa
Cando os organoides aumentan, dificúltase a subministración de alimentos e a eliminación de residuos, que dependen da difusión. Isto pode causar problemas graves, como a morte das células do centro. E que solución ten? Utilización do movemento e os biorreactores para a distribución uniforme de alimentos e osíxeno [16]. Os biorreactores crean e manteñen unha contorna controlada para que as células crezan e desenvólvanse en condicións óptimas. Controlan así o pH, a temperatura, o osíxeno e os niveis de glicosa cun dobre obxectivo: maximizar a transferencia de alimentos e, ao mesmo tempo, minimizar a tensión mecánica sobre as células [2, 16].
A bioingeniería baseada en organoides achegou unha novo paradigma na investigación en saúde ao permitir unha análise máis realista do comportamento celular e un achegamento ás aplicacións clínicas. na figura 2 pódense ver algúns exemplos significativos destas aplicacións.
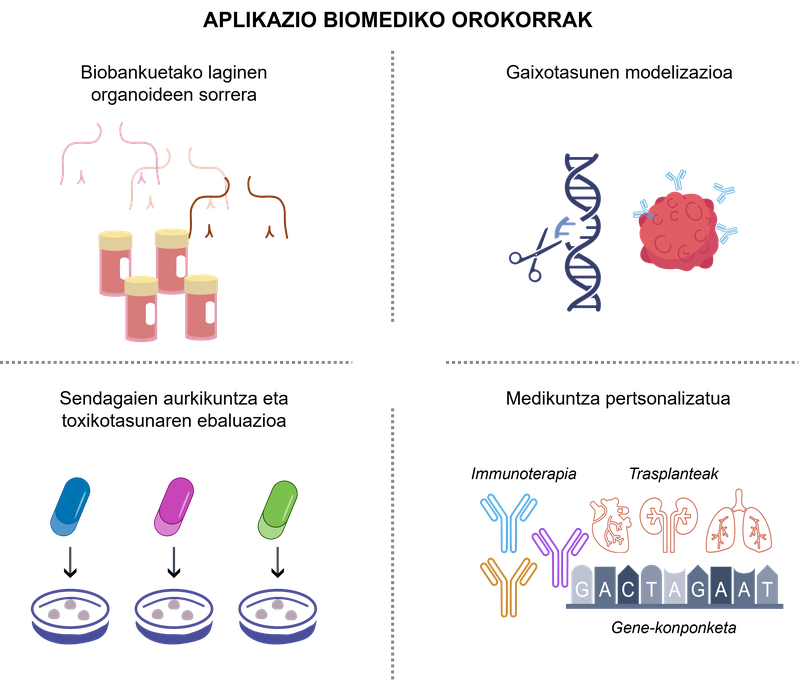
figura 2. aplicacións biomédicas dos organoides 3D.
Importancia dos biobancos
O Biobanco é unha colección sistemática de mostras biolóxicas humanas e datos asociados, concibida para fins de investigación e que permite compartir mostras con estritos controis de calidade. Con todo, as mostras necesarias para producir organoides son pobres, obtéñense por procedementos invasivos e varían moito dunha persoa a outra.
Os organoides permiten facer fronte á escaseza de persoas: a súa capacidade de autorrenovación, a súa longa vida útil e a capacidade de manter as características do tecido ao longo do tempo permiten almacenar e reutilizar os organoides dos pacientes. Isto permite deseñar tratamentos personalizados e prever a resposta dos medicamentos segundo o perfil xenético e fenotípico de cada paciente. Un claro exemplo é a “Human Cancer Models Initiative (HCMI)”, un proxecto que está a crear un biobanco global de organoides cancerosos. Con todo, existen algúns desafíos: os altos custos e a tecnoloxía complexa [17].
Modelización de enfermidades
Os organoides aparecen como unha plataforma potente e versátil para o estudo de certas condicións patolóxicas, como enfermidades infecciosas, xenéticas e cancro.
- Enfermidades infecciosas. Os organoides permiten analizar o comportamento de virus e bacterias, mellorando así a comprensión das interaccións hospedero-patóxenas e a especificidad dos antibióticos e axentes antivirus. Isto pode levar ao desenvolvemento de medicamentos antibióticos e antivirais máis específicos [18].
- Enfermidades xenéticas. Outras tecnoloxías como CRISPR/Cas9 permiten a formación de organoides con mutacións precisas para unha mellor investigación de enfermidades [19].
- Cancro. Os organoides procedentes dos tumores dos pacientes manteñen a heteroxeneidade dos tumores, abrindo así a posibilidade de probar novos tratamentos e identificar metas terapéuticas [20].
Unha ferramenta para atopar medicamentos máis rápido e seguro
Os modelos organoides son moito máis efectivos no descubrimento de medicamentos e a avaliación da toxicidade en comparación cos cultivos 2D. Ofrecen respostas fisiolóxicas máis precisas e aceleran as probas non invasivas de medicamentos personalizados para cada paciente. Ademais, reducen o uso de animais no camiño cara a unha investigación máis ética e sostible. Tamén permiten realizar screenings masivos en menos tempo e a menor custo [21].
Superar os novos límites do medicamento personalizado
O medicamento personalizado está a transformar a paradigma da atención sanitaria; o uso de datos individuais de cada paciente permite deseñar estratexias de prevención, diagnóstico e tratamento. Neste contexto, a aplicación clínica dos modelos de organoides xogará un papel fundamental, xa que os organoides derivados dos pacientes permitirán prever as respostas individuais dos medicamentos.
- Terapia do transplante. O desenvolvemento de modelos organoides de doantes de órganos - terá un impacto positivo no medicamento rexenerativo. Por exemplo, utilizáronse organoides das glándulas sudoríparas nos transplantes de ratos, lográndose a epidermis e a rexeneración destas glándulas. Con todo, existe un reto central, a falta de capacidade para crear estruturas complexas e vascularizadas [22].
- Inmunoterapia e reparación xénica. Mediante a combinación de organoides e células inmunitarias, os investigadores poden estudar as respostas inmunitarias contra tumores co obxectivo de desenvolver novos tratamentos. Por exemplo, o cocultivo con células T efectoras pode producir unha resposta inmunitaria antitumoral eficaz, reducindo a supervivencia das células organoideas tumorais e aumentando a función das células inmunitarias. Por outra banda, tamén se poden utilizar cultivos organoides para reparar mutacións xenéticas. Un dos exemplos foi o desenvolvemento de organoides retinianos, que abriu unha vía para o tratamento da perda de visión para futuras terapias xenéticas [23].
Son, pois, os organoides os novos aliados do futuro do medicamento?
Os organoides, ademais dun gran avance científico, son unha gran oportunidade para comprender a saúde e as enfermidades. Grazas á súa versatilidade, a súa capacidade para imitar tecidos humanos con maior precisión que en cultivos celulares tradicionais e a posibilidade de personalizar diagnósticos e tratamentos, ábrese un futuro prometedor no medicamento. Aínda quedan algúns retos por superar, como a estandarización das técnicas e a obtención de amplas aplicacións clínicas, pero está claro que os organoides saltaron máis aló da curiosidade de laboratorio e convertéronse nos principais aliados dun medicamento máis preciso, ética e accesible.
Imaxinade que sería estudar o cerebro humano sen abrir o cranio… Aí está o futuro da biomedicina?
Bibliografía
- Clevers, H. 2016. “Modeling Development and Disease with Organoids”. Cell 165, 1586–1597.
- Zhao, Z., Chen, X, Dowbaj, A.M. et ao. 2022. “Organoids.” Nat Rev Methods Primers 2, 94.
- Gómez-Álvarez, M. et ao. 2023. “Addressing Key Questions in Organoid Models: Who, Where, How, and Why?”. International Journal of Molecular Sciences, 24(21), 16014
- Thomson, J.A. et ao. 1998. “Embryonic Stem Cell Lines Derived from Human Blastocysts”. Science 282, 1145–1147.
- Takahashi, K., Yamanaka, S. 2006. “Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors”. Cell 126, 663–676.
- Wang, E. et ao. 2022. “Modeling Human Telencephalic Development and Autism-Associated SHANK3 Deficiency Using Organoids Generated from Single Neural Rosettes”. Nat. Commun 13, 5688.
- Ho, T.C. et ao. 2022. “Hydrogels: Properties and Applications in Biomedicine”. Molecules, 27, 2902.
- Sun, J. et ao. 2017. “Controlled Release of BMP-2 from a Collagen-Mimetic Peptide-Modified Silk Fibroin– Nanohydroxyapatite Scaffold for Bone Regeneration”. J. Mater. Chem. B, 5, 8770–8779.
- Ning, L. et ao. 2015. “Porous Collagen-Hydroxyapatite Scaffolds with Mesenchymal Stem Cells for Bone Regeneration”. J. Oral Implantol 41, 45–49.
- Goonoo, N. & Bhaw-Luximon, A. 2019. “Mimicking growth factors: role of small molecule scaffold additives in promoting tissue regeneration and repair”. RSC Adv. 9, 18124–18146.
- Siller, R. et ao. 2015. “-molecule-driven hepatocyte differentiation of human pluripotent stem cells”. Stem Cell Rep 4, 939–952.
- Takasato, M. et ao. 2015. “Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis”. Nature 526, 564–568.
- Wang, Q. et ao. 2015. “Non-genetic engineering of cells for drug delivery and cell based therapy”. Adv. Drug deliv. Rev 91, 125–140.
- Davoudi, Z. et ao. 2021. “Gut organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery”. mar Drugs 19, 282.
- Dalby, M. J. Gadegaard N. & Oreffo R. H. 2014. “Harnessing nanotopography and integrin–matrix interactions to influence stem cell fate”. Nat. Mater 13, 558–569.
- Fluri, D A, et ao. 2012. “Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures”. Nat. Methods 9, 509–516.
- National Cancer Institute (NCI). Human Cancer Models Initiative. Available online https://ocg.cancer.gov/programs/hcmi.
- Ettayebi, K. et ao. 2016. “Replication of Human Noroviruses in Stem Cell Derived Human Enteroids”. Science 353, 1387–1393.
- Schutgens, F Clevers, H. 2020. “Human Organoids: Tools for Understanding Biology and Treating Diseases”. Annu. Rev. Bagazo. Mech. Dis 15, 211–234
- 20. Vlachogiannis, G. et ao. 2018. “Patient-Derived Organoids Model Treatment Response of Metastatic Gastrointestinal Cancers”. Science 359, 920–926.
- Blomme, S.A.G., Will, E 2016. “Toxicology Strategies for Drug Discovery: Present and Future”. Chem. Res. Toxicol 29, 473–504.
- Sahara, D. et ao. 2021. “Organoids in Tissue Transplantation”. Adv. Exp. Med. Biol 1347, 45–64.
- Singh, R.K. et ao. 2015. “Derivación de Retinal Cells and Retinal Organoids from Pluripotent Stem Cells for CRISPR-Cas9 Engineering and Retinal Repair”. Investig. Ophthalmol. Vis. Sci 56, 3591.
- Verstegen, M.M.A. et ao. 2025. “Clinical applications of human organoids”. Nat Med 31(2), 409-421.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











