Les organoïdes, qu'est-ce que c'est et pourquoi la révolution est-elle en train de se produire ?
La culture des cellules en laboratoire n'est pas une nouvelle affaire. Pendant des décennies, les méthodes de culture cellulaire bidimensionnelle (2D) ont été à la base de la recherche et le principal outil pour le développement de nouvelles thérapies. Mais sont-elles suffisantes pour relever les défis de la science d'aujourd'hui ?
En réalité, les progrès de la science ont mis en évidence ses limites. Ces modèles ne sont pas capables d'imiter complètement la complexité des tissus de notre corps. Ils ne contiennent pas certains facteurs nécessaires à notre corps et à notre fonction, comme une matrice extracellulaire organisée en 3 dimensions, des signaux biochimiques spécifiques ou des stimuli environnementaux appropriés [1]. Cela pose des limites à la recherche et au développement de nouveaux traitements, car les processus qui se produisent dans le corps ne peuvent pas être analysés dans leur ensemble. Dans ce contexte, les modèles tridimensionnels (3D) ont été un grand progrès car ils conservent les principales caractéristiques des organes et des tissus. Dans ce nouveau scénario, les organoïdes sont de plus en plus considérés comme des outils prometteurs, mais... qu'est-ce qu'ils sont vraiment?...
Les organoïdes sont des structures tridimensionnelles créées à partir de cellules capables de s'organiser elles-mêmes, c'est-à-dire un ensemble de cellules capables de créer un système en s'unifiant de manière appropriée. Imaginez des mini-organes créés dans le laboratoire. Ils reproduisent à petite échelle les principales caractéristiques fonctionnelles, structurelles et biologiques des organes réels et se rapprochent de l'organisation et de la complexité fonctionnelles du passage du niveau cellulaire aux organes [2]. Ils offrent ainsi des opportunités uniques : ils permettent de comprendre le développement des organes, d'analyser l'origine des maladies (comme les cancers ou les maladies neurologiques), de tester la sécurité de nouveaux médicaments ou de progresser dans la conception de thérapies personnalisées [3]. En plus de cela, ils représentent également l'avenir de la médecine régénérative et des transplantations, faisant ainsi de ce qui est aujourd'hui plus proche de l'imagination une réalité.
Comment se forme un organoïde ? Composants essentiels pour la conception
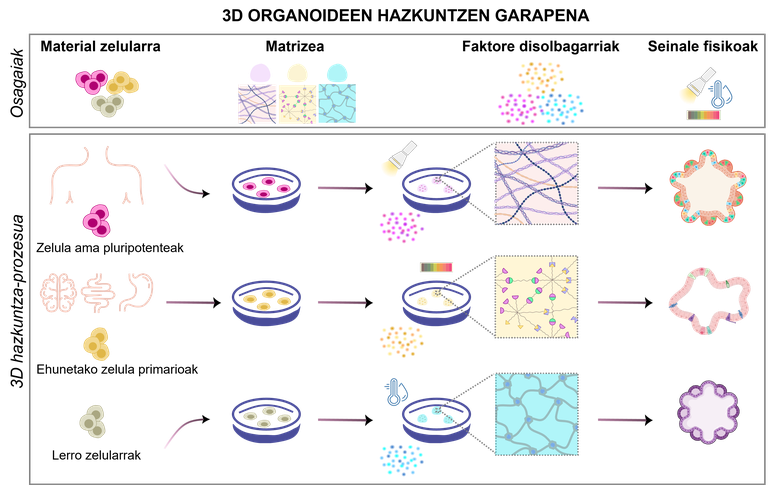
Les organoïdes sont le résultat d'un processus précis qui doit être bien conçu. Selon les objectifs de l'expérience, en modifiant les types de cellules et les composants nécessaires, il existe plusieurs conceptions possibles pour répondre aux besoins de la recherche (Figure 1). Pour ce faire, il est essentiel de prendre en compte les quatre composantes suivantes
1.Material cellulaire
Selon les objectifs de l'expérience, les cellules de production d'organoïdes peuvent être sélectionnées à partir de différentes sources:
· Cellules souches pluripotentes. En modifiant le milieu de culture utilisé, ils ont la capacité de se renouveler et de se différencier dans n'importe quel type de cellule du corps humain. Il existe deux types principaux de cellules souches embryonnaires, obtenues à partir d'embryons précoces [4] et de cellules souches pluripotentes induites (iPSC), produites par reprogrammation de cellules adultes [5].
· Cellules primaires isolées des tissus d'origine. Ils sont directement isolés des tissus foetaux ou adultes, conservant ainsi mieux leurs propriétés biologiques originales. Les cellules souches tissulaires adultes, les cellules progéniques ou les cellules somatiques différenciées peuvent être isolées à partir de tissus sains ou malades [2].
· Lignes cellulaires. Les lignées cellulaires prédéfinies en laboratoire peuvent facilement être modifiées génétiquement et manipule pour tester des médicaments personnalisés ou pour étudier des maladies rares [6]. Cependant, ces types de cellules présentent des différences significatives par rapport au modèle in vivo que l'on souhaite reproduire.
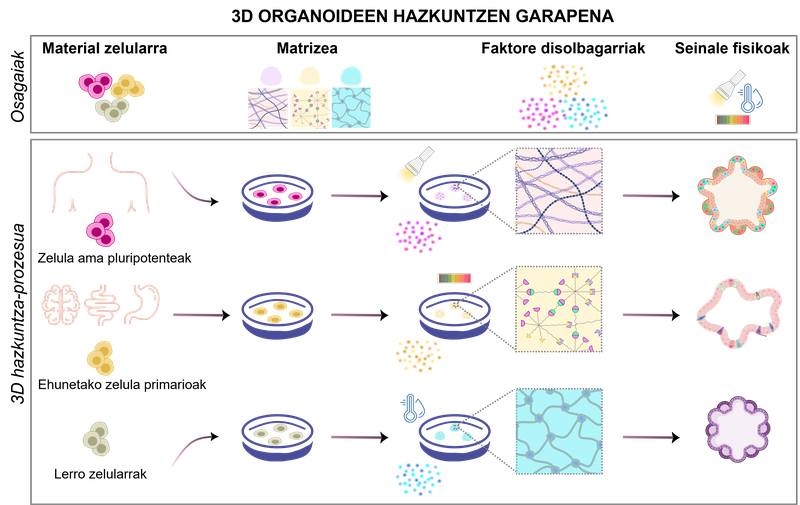
figure 1. développement de la croissance des organoïdes 3D. En fonction des biomatériaux utilisés et des conditions physico-chimiques, différents types d'organoïdes peuvent être produits.
2.Matrizea : support des cellules
La matrice extracellulaire fournit un support pour la croissance, le développement et la maintenance des organoïdes par des signaux mécaniques et biochimiques. Il imite l'environnement naturel des cellules en fournissant des stimuli mécaniques et biochimiques qui agissent sur la croissance, la différenciation et l'organisation des cellules. Aujourd'hui, les hydrogels sont les matrices les plus utilisées : ce sont des réseaux polymères capables de retenir une grande quantité d'eau et qui peuvent avoir des propriétés physico-chimiques très similaires à celles des tissus d'origine [7]. Leur principal avantage est leur capacité d'adaptation, ils adaptent la rigidité ou la porosité aux besoins de chaque organoïde. En outre, ils protègent les cellules du stress externe et permettent l'échange de nutriments et d'oxygène. Outre l'hydrogel, d'autres solutions sont à l'étude, telles que les microsphères et l'andamium poreux [8, 9].
3.Faktore solubles: responsable de l'entretien des organoïdes
Les facteurs solubles sont l'un des composants les plus importants du milieu de croissance des organoïdes. Ces molécules se lient aux récepteurs à la surface des cellules et activent les signaux internes pour initier ou inhiber des processus tels que la différenciation et/ou la prolifération cellulaire.
Dans la culture des organoïdes, ces signaux solubles sont ajoutés en laboratoire, principalement sous forme de protéines (comme les facteurs de croissance) ou de petites molécules pouvant activer les voies de signalisation [10, 11]. Mais il ne suffit pas de savoir ce qui est ajouté, il est également essentiel de savoir quand et comment il est ajouté. Dans le corps, les signaux qui déclenchent les processus sont coordonnés dans l'espace et le temps. Par exemple, pour la culture de cellules souches humaines pluripotentes et la production d'organoïdes composés de plusieurs types de cellules, cette présentation temporale spatiale est particulièrement importante [12]. Cette présentation contrôlée peut être réalisée à l'aide de différentes stratégies d'ingénierie tissulaire, telles que l'encapsulation des facteurs de croissance à l'intérieur des nanoparticules et leur fixation à la surface des cellules pour une libération contrôlée. Il est également possible d'utiliser diverses méthodes basées sur la nanotechnologie, telles que la nano-impression, la lithographie ou l'électrofiletage, pour créer des surfaces similaires à la membrane basale dans les cultures cellulaires 3D [13-15]. Grâce à ces méthodes, les molécules de signalisation sont piégées dans la membrane basale et libérées de manière contrôlée.
4.Seinale physiques: le mouvement est également important
L'augmentation des organoïdes complique l'approvisionnement alimentaire et l'élimination des déchets qui dépendent de la diffusion. Cela peut entraîner de graves problèmes, tels que la mort des cellules du centre. Et quelle solution y a-t-il ? Mouvement et utilisation de bioréacteurs pour une distribution uniforme de la nourriture et de l'oxygène [16]. Les bioréacteurs créent et maintiennent un environnement contrôlé pour que les cellules se développent et se développent dans des conditions optimales. Ils contrôlent ainsi le pH, la température, l'oxygène et les niveaux de glucose avec un double objectif: maximiser le transfert des aliments tout en minimisant le stress mécanique sur les cellules [2, 16].
La bioingénierie à base d'organoïdes a apporté un nouveau paradigme dans la recherche sur la santé en permettant une analyse plus réaliste du comportement cellulaire et une approche des applications cliniques. la figure 2 montre quelques exemples significatifs de ces applications.
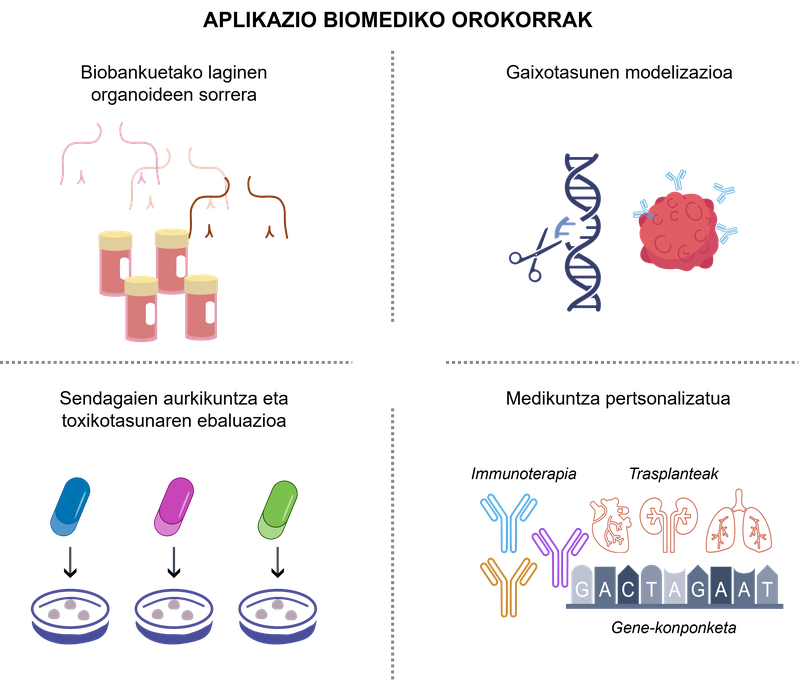
figure 2. applications biomédicales des organoïdes 3D.
L'importance des biobanques
La biobanque est une collection systématique d'échantillons biologiques humains et de données associées, conçue à des fins de recherche et permettant le partage d'échantillons avec des contrôles de qualité stricts. Cependant, les échantillons nécessaires à la production d'organoïdes sont rares, sont obtenus par des procédés invasifs et varient considérablement d'une personne à l'autre.
Les organoïdes permettent de faire face à la rareté des humanités: leur capacité d'auto-renouvellement, leur longue durée de vie et leur capacité à maintenir les caractéristiques du tissu au fil du temps permettent de conserver et de réutiliser les organoïdes des des patients. Cela permet de concevoir des traitements personnalisés et de prévoir la réponse aux médicaments en fonction du profil génétique et phénotypique de chaque patient. Un exemple clair est la Human Cancer Models Initiative (HCMI), un projet qui crée une biobanque mondiale d’organoïdes cancéreux. Cependant, il y a des défis à relever : des coûts élevés et une technologie complexe [17].
Modélisation des maladies
Les organoïdes apparaissent comme une plate-forme puissante et polyvalente pour l'étude de certaines conditions pathologiques telles que les maladies infectieuses, génétiques et le cancer.
- Maladies infectieuses. Les organoïdes permettent d'étudier le comportement des virus et des bactéries, de mieux comprendre les interactions hôte/pathogène et d'améliorer la spécificité des antibiotiques et des agents antiviraux. Cela peut conduire au développement d'antibiotiques et de médicaments antiviraux plus spécifiques [18].
- Les maladies génétiques. Le CRISPR/Cas9 et d'autres technologies similaires permettent de produire des organoïdes présentant certaines mutations afin de mieux étudier les maladies [19].
- Le cancer. Les organoïdes produits par les tumeurs des patients maintiennent l'hétérogénéité des tumeurs et ouvrent ainsi la possibilité de tester de nouveaux traitements et d'identifier des cibles thérapeutiques [20].
Un outil pour trouver des médicaments plus rapidement et en toute sécurité
Les modèles d'organoïdes sont beaucoup plus efficaces dans la découverte de médicaments et l'évaluation de la toxicité par rapport aux cultures 2D. Ils offrent des réponses physiologiques plus précises et accélèrent les tests non invasifs de médicaments personnalisés pour chaque patient. En outre, ils réduisent l'utilisation des animaux dans le cadre d'une recherche plus éthique et durable. Ils permettent également de réaliser des screenings massifs en moins de temps et à moindre coût [21].
Dépassez les nouvelles limites de la médecine personnalisée
Grâce à la médecine personnalisée, le paradigme des soins de santé est en train de changer; en utilisant les données individuelles de chaque patient, il est possible de concevoir des stratégies de prévention, de diagnostic et de traitement. Dans ce contexte, l'application clinique de modèles d'organoïdes jouera un rôle essentiel, car les organoïdes dérivés des patients permettront de prévoir des réponses individuelles aux médicaments.
- Thérapie de greffe. Le développement de modèles d'organoïdes d'organes donneurs aura un effet positif sur la médecine régénérative. Par exemple, les organoïdes des glandes sudoripares ont été utilisés dans les greffes de souris et l'épiderme et ces glandes ont été reconstituées. Cependant, il existe un défi majeur, à savoir l'incapacité à créer des structures complexes et vascularisées [22].
- Immunothérapie et réparation des gènes. En combinant les organoïdes et les cellules immunitaires, les chercheurs peuvent étudier les réponses immunitaires contre les tumeurs afin de développer de nouveaux traitements. Par exemple, la coculture avec des cellules T effectrices peut produire une réponse immunitaire antitumorale efficace, réduisant la survie des cellules tumorales organoïdes et augmentant la fonction des cellules immunitaires. D'autre part, les cultures d'organoïdes peuvent également être utilisées pour réparer les mutations génétiques. L'un des exemples est le développement d'organoïdes rétiniens, qui a ouvert la voie à de futures thérapies génétiques pour le traitement de la perte de la vision [23].
Les organoïdes sont donc les nouveaux alliés de la médecine à venir?
Les organoïdes représentent non seulement un grand progrès scientifique, mais aussi une excellente occasion de comprendre la santé et les maladies. Sa polyvalence, sa capacité à imiter les tissus humains avec plus de précision que dans les cultures cellulaires traditionnelles et la possibilité de personnaliser les diagnostics et les traitements ouvrent un avenir prometteur en médecine. Il y a encore des défis à relever, comme la standardisation des techniques et la réalisation d’applications cliniques étendues, mais il est clair que les organoïdes ont franchi la curiosité du laboratoire et sont devenus les principaux alliés d’une médecine plus précise, plus éthique et plus accessible.
Imaginez ce que c'est que d'étudier le cerveau humain sans ouvrir un crâne. Est-ce que l'avenir de la biomédecine est là ?
Bibliographie et sources
- Clevers, H. 2016. “Modeling Development and Disease with Organoids”. Cell 165, 1586–1597.
- Zhao, Z Chen, X Dowbaj, A.M. et al. 2022. “Organoids.” Nat Rev Methods Primers 2, 94.
- Gómez-Álvarez, M. et al. 2023. “Addressing Key Questions in Organoid Models: Who, Where, How, and Why?”. International Journal of Molecular Sciences, 24(21), 16014.
- Thomson, J.A. et al.1998. “Embryonic Stem Cell Lines Derived from Human Blastocysts”. Science 282, 1145–1147.
- Takahashi, K Yamanaka, S. 2006. “Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors”. Cell 126, 663–676.
- Wang, Y. et al. 2022. “Modeling Human Telencephalic Development and Autism-Associated SHANK3 Deficiency Using Organoids Generated from Single Neural Rosettes”. Nat ! Commun 13, 5688.
- Ho, T. C. " Et al. 2022. “Hydrogels: Properties and Applications in Biomedicine ». Molecules, 27, 2902.
- Sun, J. et al. 2017. “Controlled Release of BMP-2 from a Collagen-Mimetic Peptide-Modified Silk Fibroin – Nanohydroxyapatite Scaffold for Bone Regeneration”. J... Mater ? Chem ! B, 5, 8770–8779.
- Ning, L. et al. 2015. “Porous Collagen-Hydroxyapatite Scaffolds with Mesenchymal Stem Cells for Bone Regeneration”. J... Oralol 41, 45 à 49.
- Goonoo, N. & Bhaw-Luximon, A. 2019. “Mimicking growth factors: role of small molecule scaffold additives in promoting tissue regeneration and repair”. RSC Adv. 9, 18124–18146.
- Siller, R. et al. 2015. “Small-molecul-driven hepocyte differentiation of human pluripotent stem cells”. Stem Cell Rep 4, 939–952.
- Takasato, M. et al. 2015. « Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis ». Nature 526, 564–568.
- Wang, Q. et al. 2015. non-genetic engineering of cells for drug delivery and cell-based therapy. Adv. Drug Deliv. Rév. 91, 125–140.
- Davoudi, Z. et al. 2021. “Gut organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery”. mar Drugs 19, 282.
- Dalby, M. J., Gadegaard, N. oreffo, R. Oh ! 2014. harnessing nanotopography and integrin–matrix interactions to stem cell fate. Nat ! Mater n° 13, 558–569.
- Fluri, D. A. et al. 2012. « Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures ». Nat ! Methods 9, 509, 516.
- Institut national du cancer (NCI). Human Cancer Models Initiative. Disponible en ligne https://ocg.cancer.gov/programs/hcmi.
- Ettayebi, K. et al. 2016. “Réplication of Human Noroviruses in Stem Cell-Derived Human Enteroids”. Science 353, 1387–1393.
- Schutgens, F Clevers, H. 2020. “Human Organoids: Tools for Understanding Biology and Treating Diseases." Annu... Rév. Pathol ! Mech. Dis 15, 211–234
- 20. Vlachogiannis, G. et al. 2018. “Patient-Derived Organoids Model Treatment Response of Metastatic Gastro-intestinal Cancers”. Science 359, 920, 926.
- Blomme, E.A.G., Will, Y. 2016. “Toxicology Strategies for Drug Discovery: Present et Future ». Chem ! Res. Toxicol 29, 473–504.
- Sağ raç, D. et al. 2021. “Organoids in Tissue Transplantation”. Adv. Exp. Méd. Biol 1347, 45–64.
- R. K. et al. 2015. “Derivation of Retinal Cells and Retinal Organoids from Pluripotent Stem Cells for CRISPR-Cas9 Engineering and Retinal Repair”. Investig. Ophthalmol. - Vis. Serment 56, 3591.
- Verstegen, M.M.A. " Et al. 2025. applications cliniques des organismes humains. Nat Med 31(2), 409-421.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











