Organoides, ¿qué son y por qué están revolucionando?
El cultivo de células en el laboratorio no es una cuestión nueva. Durante décadas, los métodos de cultivo celular bidimensional (2D) han sido la base de la investigación y la principal herramienta para el desarrollo de nuevas terapias. Pero... ¿son suficientes para responder a los retos de la ciencia de hoy?
En realidad, sus limitaciones han sido puestas de manifiesto por los avances en ciencia. Estos modelos no son capaces de imitar completamente la complejidad de los tejidos de nuestro cuerpo. Carecen de algunos factores necesarios para nuestro cuerpo y función, como la matriz extracelular organizada en 3 dimensiones, las señales bioquímicas específicas o los estímulos ambientales adecuados [1]. Esto pone límites a la investigación y al desarrollo de nuevos tratamientos porque los procesos que ocurren en el cuerpo no pueden ser examinados en su totalidad. En este contexto, los modelos tridimensionales (3D) han supuesto un gran avance, ya que conservan las principales características de los órganos y tejidos. En este nuevo escenario, los organoides están destacando cada vez más como instrumentos prometedores, pero... ¿qué son realmente?.
Son estructuras tridimensionales formadas por células que tienen la capacidad de autoorganizarse, es decir, un conjunto de células capaces de producir un sistema perfectamente unificado. Imagina algunos miniórganos creados en el laboratorio. Replican a pequeña escala las principales características funcionales, estructurales y biológicas de los órganos reales, acercándose a la organización y complejidad funcional del paso del nivel celular a los órganos [2]. Permiten entender el desarrollo de los órganos, estudiar el origen de las enfermedades, como los cánceres o las enfermedades neurológicas, probar la seguridad de nuevos fármacos o avanzar en el diseño de terapias personalizadas [3]. Además, representan el futuro de la medicina regenerativa y los trasplantes, haciendo realidad lo que hoy en día es más cercano a la imaginación.
¿Cómo se forma un organoide? Componentes clave para el diseño
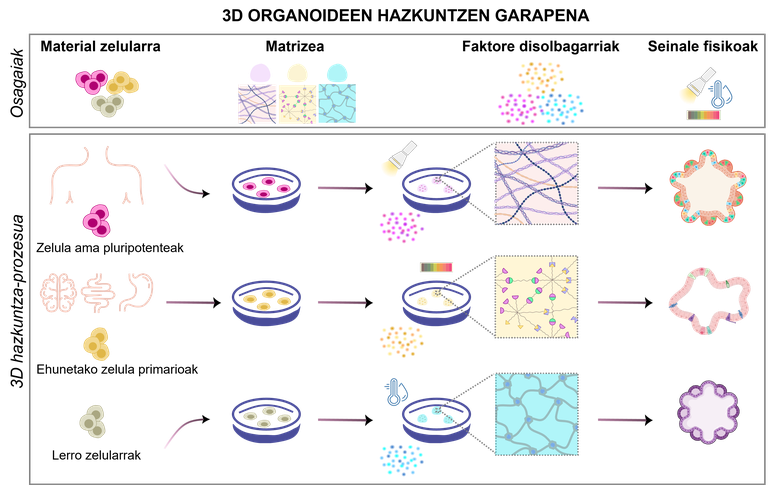
Los organoides son el resultado de un proceso específico que debe diseñarse adecuadamente. Dependiendo de los objetivos del experimento, cambiando los tipos celulares y los componentes necesarios, hay varios diseños posibles para responder a las necesidades de la investigación (Figura 1). Para ello, es fundamental tener en cuenta estos cuatro componentes:
1.Material celular
Dependiendo de los objetivos del experimento, las células generadoras de organoides se pueden seleccionar de diferentes fuentes:
· Células madre pluripotentes. Tienen la capacidad de innovar y diferenciar en cualquier tipo de células del cuerpo humano cambiando el medio de crecimiento utilizado. Existen dos tipos principales: las células madre embrionarias, obtenidas a partir de embriones precoces [4]; y las células madre pluripotentes inducidas (iPSC), producidas por reprogramación de células adultas [5].
· Células primarias aisladas de los tejidos originales. Se aíslan directamente de tejidos fetales o adultos, manteniendo así mejor las propiedades biológicas originales. Las células madre adultas de los tejidos, las células progenitoras o las células somáticas separadas se pueden aislar tanto de tejidos sanos como de enfermos [2].
· Líneas celulares. Las líneas celulares preestablecidas en los laboratorios pueden ser fácilmente manipuladas y modificadas genéticamente para probar medicamentos personalizados o investigar enfermedades raras [6]. Sin embargo, estos tipos celulares difieren significativamente del modelo in vivo que se pretende replicar.
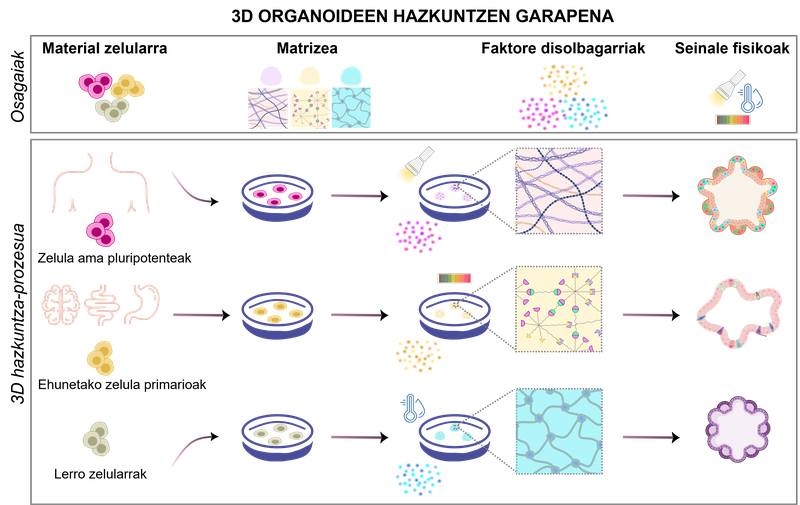
figura 1. desarrollo de cultivos de organoides 3D. Dependiendo de los biomateriales y de las condiciones físico-químicas utilizadas, pueden formarse diferentes tipos de organoides.
2.Matrizea: soporte de células
La matriz extracelular proporciona soporte para el crecimiento, desarrollo y mantenimiento de organoides mediante señales mecánicas y bioquímicas. Imita el entorno natural de las células, ofreciendo estímulos mecánicos y bioquímicos que influyen en el crecimiento, diferenciación y organización de las células. Actualmente, las matrices más utilizadas son los hidrogeles, que son redes poliméricas capaces de retener una gran cantidad de agua y que pueden tener propiedades físico-químicas muy similares a las de los tejidos originales [7]. Su principal ventaja es su adaptabilidad, la rigidez o porosidad la adaptan a las necesidades de cada organoide. Además, protegen a las células del estrés externo y permiten el intercambio de nutrientes y oxígeno. Además de los hidrogeles, se están estudiando otras alternativas como las microesferas y los andamios porosos [8, 9].
3.Faktore solubles: responsables del mantenimiento de los organoides
Los factores solubles son uno de los componentes más importantes en el medio de crecimiento de los organoides. Estas moléculas se unen a los receptores de la superficie celular y activan señales internas para iniciar o inhibir ciertos procesos, como la separación y/o la proliferación celular.
En el cultivo de organoides, estas señales solubles se agregan en el laboratorio, principalmente como proteínas (como los factores de crecimiento) o pequeñas moléculas que pueden activar los senderos de señalización [10, 11]. Pero no basta con saber qué se añade, también es fundamental saber cuándo y cómo se añade. En el cuerpo, las señales que ponen en marcha los procesos están coordinadas en el espacio y el tiempo. Por ejemplo, para el crecimiento de células madre humanas pluripotentes y para la formación de organoides formados por diferentes tipos celulares, es especialmente importante esta presentación espacio-temporal [12]. Esta presentación controlada se puede lograr a través de varias estrategias de ingeniería de tejidos, como encapsular los factores de crecimiento dentro de las nanopartículas y fijarlos en la superficie de las células para que se liberen de forma controlada. También pueden utilizarse algunos métodos basados en la nanotecnología, como la nanoimpresión, la litografía o la electrodeposición, para generar superficies similares a la membrana basal en cultivos celulares 3D [13-15]. Mediante estos métodos, las moléculas de señalización quedan atrapadas en la membrana basal y liberadas de forma controlada.
4.Seinale físicas: el movimiento también importa
Cuando los organoides aumentan, se dificulta el suministro de alimentos y la eliminación de residuos, que dependen de la difusión. Esto puede causar problemas graves, como la muerte de las células del centro. ¿Y qué solución tiene? Utilización del movimiento y los biorreactores para la distribución uniforme de alimentos y oxígeno [16]. Los biorreactores crean y mantienen un entorno controlado para que las células crezcan y se desarrollen en condiciones óptimas. Controlan así el pH, la temperatura, el oxígeno y los niveles de glucosa con un doble objetivo: maximizar la transferencia de alimentos y, al mismo tiempo, minimizar el estrés mecánico sobre las células [2, 16].
La bioingeniería basada en organoides ha aportado un nuevo paradigma en la investigación en salud al permitir un análisis más realista del comportamiento celular y un acercamiento a las aplicaciones clínicas. en la figura 2 se pueden ver algunos ejemplos significativos de estas aplicaciones.
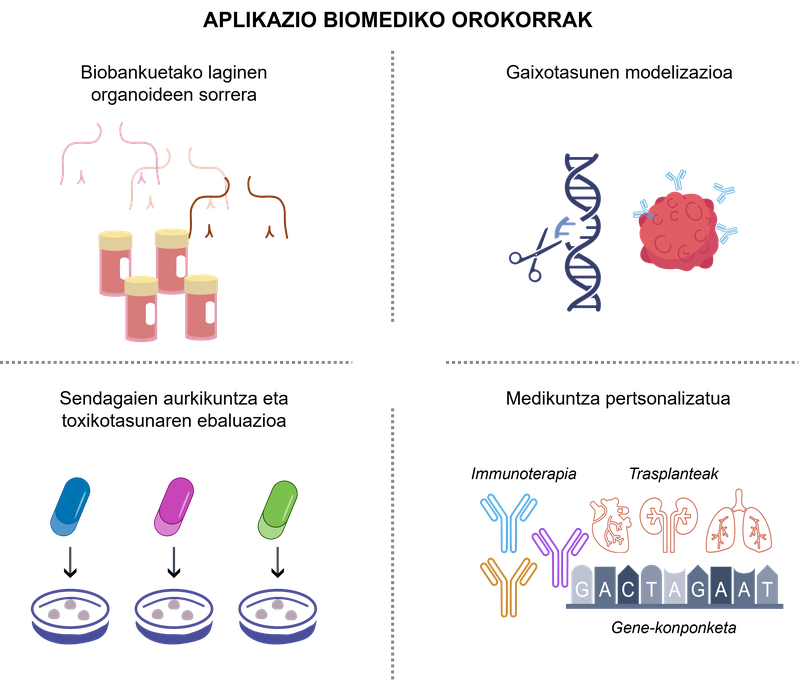
figura 2. aplicaciones biomédicas de los organoides 3D.
Importancia de los biobancos
El Biobanco es una colección sistemática de muestras biológicas humanas y datos asociados, concebida para fines de investigación y que permite compartir muestras con estrictos controles de calidad. Sin embargo, las muestras necesarias para producir organoides son pobres, se obtienen por procedimientos invasivos y varían mucho de una persona a otra.
Los organoides permiten hacer frente a la escasez de personas: su capacidad de autorrenovación, su larga vida útil y la capacidad de mantener las características del tejido a lo largo del tiempo permiten almacenar y reutilizar los organoides de los pacientes. Esto permite diseñar tratamientos personalizados y prever la respuesta de los medicamentos según el perfil genético y fenotípico de cada paciente. Un claro ejemplo es la “Human Cancer Models Initiative (HCMI)”, un proyecto que está creando un biobanco global de organoides cancerosos. Sin embargo, existen algunos desafíos: los altos costos y la tecnología compleja [17].
Modelización de enfermedades
Los organoides aparecen como una plataforma potente y versátil para el estudio de ciertas condiciones patológicas, como enfermedades infecciosas, genéticas y cáncer.
- Enfermedades infecciosas. Los organoides permiten analizar el comportamiento de virus y bacterias, mejorando así la comprensión de las interacciones hospedero-patógenas y la especificidad de los antibióticos y agentes antivirus. Esto puede llevar al desarrollo de medicamentos antibióticos y antivirales más específicos [18].
- Enfermedades genéticas. Otras tecnologías como CRISPR/Cas9 permiten la formación de organoides con mutaciones precisas para una mejor investigación de enfermedades [19].
- Cáncer. Los organoides procedentes de los tumores de los pacientes mantienen la heterogeneidad de los tumores, abriendo así la posibilidad de probar nuevos tratamientos e identificar metas terapéuticas [20].
Una herramienta para encontrar medicamentos más rápido y seguro
Los modelos organoides son mucho más efectivos en el descubrimiento de medicamentos y la evaluación de la toxicidad en comparación con los cultivos 2D. Ofrecen respuestas fisiológicas más precisas y aceleran las pruebas no invasivas de medicamentos personalizados para cada paciente. Además, reducen el uso de animales en el camino hacia una investigación más ética y sostenible. También permiten realizar screenings masivos en menos tiempo y a menor coste [21].
Superar los nuevos límites de la medicina personalizada
La medicina personalizada está transformando el paradigma de la atención sanitaria; el uso de datos individuales de cada paciente permite diseñar estrategias de prevención, diagnóstico y tratamiento. En este contexto, la aplicación clínica de los modelos de organoides jugará un papel fundamental, ya que los organoides derivados de los pacientes permitirán prever las respuestas individuales de los medicamentos.
- Terapia del trasplante. El desarrollo de modelos organoides de donantes de órganos - tendrá un impacto positivo en la medicina regenerativa. Por ejemplo, se han utilizado organoides de las glándulas sudoríparas en los trasplantes de ratones, lográndose la epidermis y la regeneración de estas glándulas. Sin embargo, existe un reto central, la falta de capacidad para crear estructuras complejas y vascularizadas [22].
- Inmunoterapia y reparación génica. Mediante la combinación de organoides y células inmunitarias, los investigadores pueden estudiar las respuestas inmunitarias contra tumores con el objetivo de desarrollar nuevos tratamientos. Por ejemplo, el cocultivo con células T efectoras puede producir una respuesta inmunitaria antitumoral eficaz, reduciendo la supervivencia de las células organoideas tumorales y aumentando la función de las células inmunitarias. Por otra parte, también se pueden utilizar cultivos organoides para reparar mutaciones genéticas. Uno de los ejemplos ha sido el desarrollo de organoides retinianos, que ha abierto una vía para el tratamiento de la pérdida de visión para futuras terapias genéticas [23].
¿Son, pues, los organoides los nuevos aliados del futuro de la medicina?
Los organoides, además de un gran avance científico, son una gran oportunidad para comprender la salud y las enfermedades. Gracias a su versatilidad, su capacidad para imitar tejidos humanos con mayor precisión que en cultivos celulares tradicionales y la posibilidad de personalizar diagnósticos y tratamientos, se abre un futuro prometedor en la medicina. Aún quedan algunos retos por superar, como la estandarización de las técnicas y la obtención de amplias aplicaciones clínicas, pero está claro que los organoides han saltado más allá de la curiosidad de laboratorio y se han convertido en los principales aliados de una medicina más precisa, ética y accesible.
Imaginad qué sería estudiar el cerebro humano sin abrir el cráneo… ¿Ahí está el futuro de la biomedicina?
Bibliografía
- Clevers, H. 2016. “Modeling Development and Disease with Organoids”. Cell 165, 1586–1597.
- Zhao, Z., Chen, X, Dowbaj, A.M. et al. 2022. “Organoids.” Nat Rev Methods Primers 2, 94.
- Gómez-Álvarez, M. et al. 2023. “Addressing Key Questions in Organoid Models: Who, Where, How, and Why?”. International Journal of Molecular Sciences, 24(21), 16014
- Thomson, J.A. et al. 1998. “Embryonic Stem Cell Lines Derived from Human Blastocysts”. Science 282, 1145–1147.
- Takahashi, K., Yamanaka, S. 2006. “Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors”. Cell 126, 663–676.
- Wang, Y. et al. 2022. “Modeling Human Telencephalic Development and Autism-Associated SHANK3 Deficiency Using Organoids Generated from Single Neural Rosettes”. Nat. Commun 13, 5688.
- Ho, T.C. et al. 2022. “Hydrogels: Properties and Applications in Biomedicine”. Molecules, 27, 2902.
- Sun, J. et al. 2017. “Controlled Release of BMP-2 from a Collagen-Mimetic Peptide-Modified Silk Fibroin– Nanohydroxyapatite Scaffold for Bone Regeneration”. J. Mater. Chem. B, 5, 8770–8779.
- Ning, L. et al. 2015. “Porous Collagen-Hydroxyapatite Scaffolds with Mesenchymal Stem Cells for Bone Regeneration”. J. Oral Implantol 41, 45–49.
- Goonoo, N. & Bhaw-Luximon, A. 2019. “Mimicking growth factors: role of small molecule scaffold additives in promoting tissue regeneration and repair”. RSC Adv. 9, 18124–18146.
- Siller, R. et al. 2015. “-molecule-driven hepatocyte differentiation of human pluripotent stem cells”. Stem Cell Rep 4, 939–952.
- Takasato, M. et al. 2015. “Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis”. Nature 526, 564–568.
- Wang, Q. et al. 2015. “Non-genetic engineering of cells for drug delivery and cell based therapy”. Adv. Drug deliv. Rev 91, 125–140.
- Davoudi, Z. et al. 2021. “Gut organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery”. mar Drugs 19, 282.
- Dalby, M. J. Gadegaard N. & Oreffo R. H. 2014. “Harnessing nanotopography and integrin–matrix interactions to influence stem cell fate”. Nat. Mater 13, 558–569.
- Fluri, D A, et al. 2012. “Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures”. Nat. Methods 9, 509–516.
- National Cancer Institute (NCI). Human Cancer Models Initiative. Available online https://ocg.cancer.gov/programs/hcmi.
- Ettayebi, K. et al. 2016. “Replication of Human Noroviruses in Stem Cell Derived Human Enteroids”. Science 353, 1387–1393.
- Schutgens, F Clevers, H. 2020. “Human Organoids: Tools for Understanding Biology and Treating Diseases”. Annu. Rev. Orujo. Mech. Dis 15, 211–234
- 20. Vlachogiannis, G. et al. 2018. “Patient-Derived Organoids Model Treatment Response of Metastatic Gastrointestinal Cancers”. Science 359, 920–926.
- Blomme, S.A.G., Will, Y 2016. “Toxicology Strategies for Drug Discovery: Present and Future”. Chem. Res. Toxicol 29, 473–504.
- Sáhara, D. et al. 2021. “Organoids in Tissue Transplantation”. Adv. Exp. Med. Biol 1347, 45–64.
- Singh, R.K. et al. 2015. “Derivación de Retinal Cells and Retinal Organoids from Pluripotent Stem Cells for CRISPR-Cas9 Engineering and Retinal Repair”. Investig. Ophthalmol. Vis. Sci 56, 3591.
- Verstegen, M.M.A. et al. 2025. “Clinical applications of human organoids”. Nat Med 31(2), 409-421.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











