Organoides, què són i per què estan revolucionant?
El cultiu de cèl·lules en el laboratori no és una qüestió nova. Durant dècades, els mètodes de cultiu cel·lular bidimensional (2D) han estat la base de la recerca i la principal eina per al desenvolupament de noves teràpies. Però... són suficients per a respondre als reptes de la ciència d'avui?
En realitat, les seves limitacions han estat posades de manifest pels avanços en ciència. Aquests models no són capaços d'imitar completament la complexitat dels teixits del nostre cos. Manquen d'alguns factors necessaris per al nostre cos i funció, com la matriu extracelul·lar organitzada en 3 dimensions, els senyals bioquímics específics o els estímuls ambientals adequats [1]. Això posa límits a la recerca i al desenvolupament de nous tractaments perquè els processos que ocorren en el cos no poden ser examinats íntegrament. En aquest context, els models tridimensionals (3D) han suposat un gran avanç, ja que conserven les principals característiques dels òrgans i teixits. En aquest nou escenari, els organoides estan destacant cada vegada més com a instruments prometedors, però... què són realment?.
Són estructures tridimensionals formades per cèl·lules que tenen la capacitat d'autoorganitzar-se, és a dir, un conjunt de cèl·lules capaces de produir un sistema perfectament unificat. Imagina alguns miniórganos creats en el laboratori. Repliquen a petita escala les principals característiques funcionals, estructurals i biològiques dels òrgans reals, acostant-se a l'organització i complexitat funcional del pas del nivell cel·lular als òrgans [2]. Permeten entendre el desenvolupament dels òrgans, estudiar l'origen de les malalties, com els càncers o les malalties neurològiques, provar la seguretat de nous fàrmacs o avançar en el disseny de teràpies personalitzades [3]. A més, representen el futur de la medicina regenerativa i els trasplantaments, fent realitat el que avui dia és més pròxim a la imaginació.
Com es forma un organoide? Components clau per al disseny
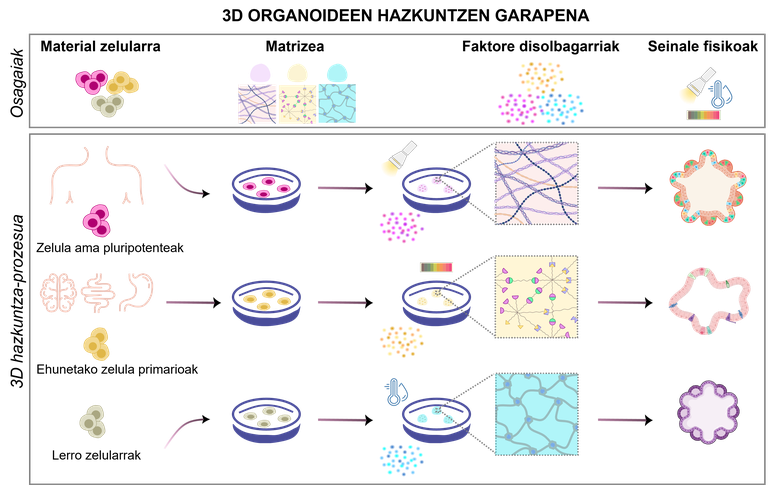
Els organoides són el resultat d'un procés específic que ha de dissenyar-se adequadament. Depenent dels objectius de l'experiment, canviant els tipus cel·lulars i els components necessaris, hi ha diversos dissenys possibles per a respondre a les necessitats de la recerca (Figura 1). Per a això, és fonamental tenir en compte aquests quatre components:
1.Material cel·lular
Depenent dels objectius de l'experiment, les cèl·lules generadores d'organoides es poden seleccionar de diferents fonts:
· Cèl·lules mare pluripotents. Tenen la capacitat d'innovar i diferenciar en qualsevol tipus de cèl·lules del cos humà canviant el mitjà de creixement utilitzat. Existeixen dos tipus principals: les cèl·lules mare embrionàries, obtingudes a partir d'embrions precoços [4]; i les cèl·lules mare pluripotents induïdes (iPSC), produïdes per reprogramació de cèl·lules adultes [5].
· Cèl·lules primàries aïllades dels teixits originals. S'aïllen directament de teixits fetals o adults, mantenint així millor les propietats biològiques originals. Les cèl·lules mare adultes dels teixits, les cèl·lules progenitores o les cèl·lules somàtiques separades es poden aïllar tant de teixits sans com de malalts [2].
· Línies cel·lulars. Les línies cel·lulars preestablertes en els laboratoris poden ser fàcilment manipulades i modificades genèticament per a provar medicaments personalitzats o investigar malalties rares [6]. No obstant això, aquests tipus cel·lulars difereixen significativament del model in vivo que es pretén replicar.
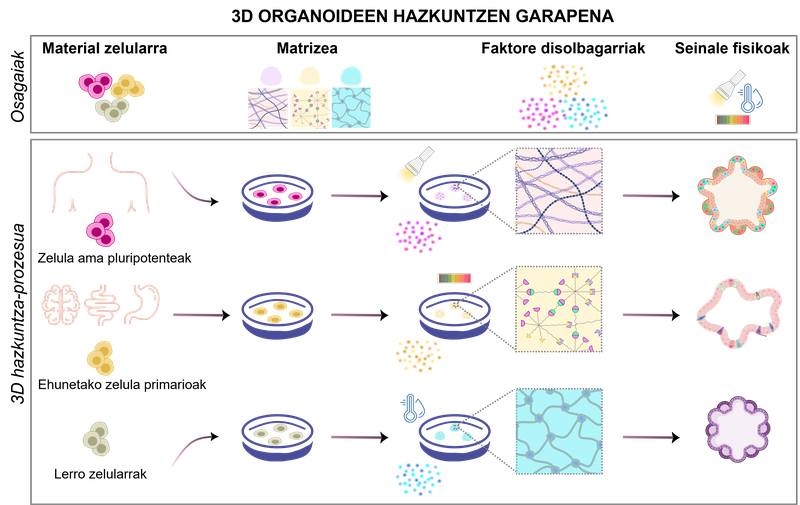
figura 1. desenvolupament de cultius d'organoides 3D. Depenent dels biomaterials i de les condicions fisicoquímiques utilitzades, poden formar-se diferents tipus d'organoides.
2.Matrizea: suport de cèl·lules
La matriu extracelul·lar proporciona suport per al creixement, desenvolupament i manteniment d'organoides mitjançant senyals mecànics i bioquímiques. Imita l'entorn natural de les cèl·lules, oferint estímuls mecànics i bioquímicos que influeixen en el creixement, diferenciació i organització de les cèl·lules. Actualment, les matrius més utilitzades són els hidrogels, que són xarxes polimèriques capaces de retenir una gran quantitat d'aigua i que poden tenir propietats fisicoquímiques molt similars a les dels teixits originals [7]. El seu principal avantatge és la seva adaptabilitat, la rigidesa o porositat l'adapten a les necessitats de cada organoide. A més, protegeixen les cèl·lules de l'estrès extern i permeten l'intercanvi de nutrients i oxigen. A més dels hidrogels, s'estan estudiant altres alternatives com les microesferes i les bastides poroses [8, 9].
3.Faktore solubles: responsables del manteniment dels organoides
Els factors solubles són un dels components més importants en el mitjà de creixement dels organoides. Aquestes molècules s'uneixen als receptors de la superfície cel·lular i activen senyals interns per a iniciar o inhibir uns certs processos, com la separació i/o la proliferació cel·lular.
En el cultiu d'organoides, aquests senyals solubles s'agreguen en el laboratori, principalment com a proteïnes (com els factors de creixement) o petites molècules que poden activar les senderes de senyalització [10, 11]. Però no n'hi ha prou amb saber què s'afegeix, també és fonamental saber quan i com s'afegeix. En el cos, els senyals que posen en marxa els processos estan coordinades en l'espai i el temps. Per exemple, per al creixement de cèl·lules mare humanes pluripotents i per a la formació d'organoides formats per diferents tipus cel·lulars, és especialment important aquesta presentació espaciotemporal [12]. Aquesta presentació controlada es pot aconseguir a través de diverses estratègies d'enginyeria de teixits, com encapsular els factors de creixement dins de les nanopartícules i fixar-los en la superfície de les cèl·lules perquè s'alliberin de manera controlada. També poden utilitzar-se alguns mètodes basats en la nanotecnologia, com la nanoimpresión, la litografia o l'electrodeposición, per a generar superfícies similars a la membrana basal en cultius cel·lulars 3D [13-15]. Mitjançant aquests mètodes, les molècules de senyalització queden atrapades en la membrana basal i alliberades de manera controlada.
4.Seinale físiques: el moviment també importa
Quan els organoides augmenten, es dificulta el subministrament d'aliments i l'eliminació de residus, que depenen de la difusió. Això pot causar problemes greus, com la mort de les cèl·lules del centre. I quina solució té? Utilització del moviment i els bioreactors per a la distribució uniforme d'aliments i oxigen [16]. Els bioreactors creen i mantenen un entorn controlat perquè les cèl·lules creixin i es desenvolupin en condicions òptimes. Controlen així el pH, la temperatura, l'oxigen i els nivells de glucosa amb un doble objectiu: maximitzar la transferència d'aliments i, al mateix temps, minimitzar l'estrès mecànic sobre les cèl·lules [2, 16].
La bioingeniería basada en organoides ha aportat un nou paradigma en la recerca en salut en permetre una anàlisi més realista del comportament cel·lular i un acostament a les aplicacions clíniques. en la figura 2 es poden veure alguns exemples significatius d'aquestes aplicacions.
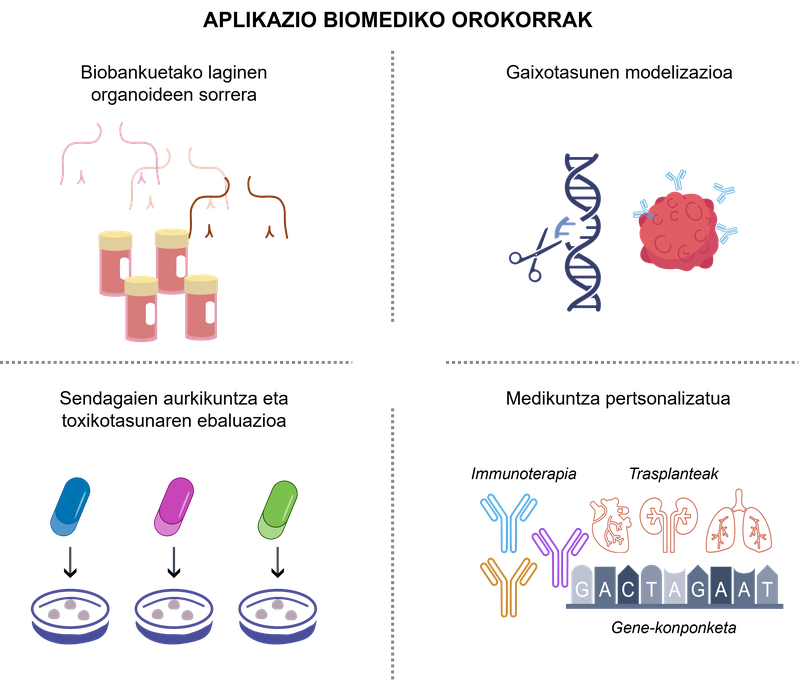
figura 2. aplicacions biomèdiques dels organoides 3D.
Importància dels biobancs
El Biobanc és una col·lecció sistemàtica de mostres biològiques humanes i dades associades, concebuda per a fins de recerca i que permet compartir mostres amb estrictes controls de qualitat. No obstant això, les mostres necessàries per a produir organoides són pobres, s'obtenen per procediments invasius i varien molt d'una persona a una altra.
Els organoides permeten fer front a l'escassetat de persones: la seva capacitat d'autorenovació, la seva llarga vida útil i la capacitat de mantenir les característiques del teixit al llarg del temps permeten emmagatzemar i reutilitzar els organoides dels pacients. Això permet dissenyar tractaments personalitzats i preveure la resposta dels medicaments segons el perfil genètic i fenotípic de cada pacient. Un clar exemple és la “Human Cancer Models Initiative (HCMI)”, un projecte que està creant un biobanc global d'organoides cancerosos. No obstant això, existeixen alguns desafiaments: els alts costos i la tecnologia complexa [17].
Modelització de malalties
Els organoides apareixen com una plataforma potent i versàtil per a l'estudi d'unes certes condicions patològiques, com a malalties infeccioses, genètiques i càncer.
- Malalties infeccioses. Els organoides permeten analitzar el comportament de virus i bacteris, millorant així la comprensió de les interaccions hospedero-patògenes i l'especificitat dels antibiòtics i agents antivirus. Això pot portar al desenvolupament de medicaments antibiòtics i antivirals més específics [18].
- Malalties genètiques. Altres tecnologies com CRISPR/Cas9 permeten la formació d'organoides amb mutacions precises per a una millor recerca de malalties [19].
- Càncer. Els organoides procedents dels tumors dels pacients mantenen l'heterogeneïtat dels tumors, obrint així la possibilitat de provar nous tractaments i identificar metes terapèutiques [20].
Una eina per a trobar medicaments més ràpid i segur
Els models organoides són molt més efectius en el descobriment de medicaments i l'avaluació de la toxicitat en comparació amb els cultius 2D. Ofereixen respostes fisiològiques més precises i acceleren les proves no invasives de medicaments personalitzats per a cada pacient. A més, redueixen l'ús d'animals en el camí cap a una recerca més ètica i sostenible. També permeten realitzar cribratges massius en menys temps i a menor cost [21].
Superar els nous límits de la medicina personalitzada
La medicina personalitzada està transformant el paradigma de l'atenció sanitària; l'ús de dades individuals de cada pacient permet dissenyar estratègies de prevenció, diagnòstic i tractament. En aquest context, l'aplicació clínica dels models d'organoides jugarà un paper fonamental, ja que els organoides derivats dels pacients permetran preveure les respostes individuals dels medicaments.
- Teràpia del trasplantament. El desenvolupament de models organoides de donants d'òrgans - tindrà un impacte positiu en la medicina regenerativa. Per exemple, s'han utilitzat organoides de les glàndules sudorípares en els trasplantaments de ratolins, aconseguint-se l'epidermis i la regeneració d'aquestes glàndules. No obstant això, existeix un repte central, la falta de capacitat per a crear estructures complexes i vascularitzades [22].
- Immunoteràpia i reparació gènica. Mitjançant la combinació d'organoides i cèl·lules immunitàries, els investigadors poden estudiar les respostes immunitàries contra tumors amb l'objectiu de desenvolupar nous tractaments. Per exemple, el cocultivo amb cèl·lules T efectores pot produir una resposta immunitària antitumoral eficaç, reduint la supervivència de les cèl·lules organoideas tumorals i augmentant la funció de les cèl·lules immunitàries. D'altra banda, també es poden utilitzar cultius organoides per a reparar mutacions genètiques. Un dels exemples ha estat el desenvolupament d'organoides retinals, que ha obert una via per al tractament de la pèrdua de visió per a futures teràpies genètiques [23].
Son, doncs, els organoides els nous aliats del futur de la medicina?
Els organoides, a més d'un gran avanç científic, són una gran oportunitat per a comprendre la salut i les malalties. Gràcies a la seva versatilitat, la seva capacitat per a imitar teixits humans amb major precisió que en cultius cel·lulars tradicionals i la possibilitat de personalitzar diagnòstics i tractaments, s'obre un futur prometedor en la medicina. Encara queden alguns reptes per superar, com l'estandardització de les tècniques i l'obtenció d'àmplies aplicacions clíniques, però és clar que els organoides han saltat més enllà de la curiositat de laboratori i s'han convertit en els principals aliats d'una medicina més precisa, ètica i accessible.
Imagineu què seria estudiar el cervell humà sense obrir el crani… Aquí està el futur de la biomedicina?
Bibliografia
- Clevers, H. 2016. “Modeling Development and Disease with Organoids”. Cell 165, 1586–1597.
- Zhao, Z., Chen, X, Dowbaj, A. m. et al . 2022. “Organoids.” Nat Rev Methods Primers 2, 94.
- Gómez-Álvarez, M. et al. 2023. “Addressing Key Questions in Organoid Models: Who, Where, How, and Why?”. International Journal of Molecular Sciences, 24(21), 16014
- Thomson, J.A. et al. 1998. “Embryonic Stem Cell Lines Derived from Human Blastocysts”. Science 282, 1145–1147.
- Takahashi, K., Yamanaka, S. 2006. “Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors”. Cell 126, 663–676.
- Wang, I. et al. 2022. “Modeling Human Telencephalic Development and Autism-Associated SHANK3 Deficiency Using Organoids Generated from Single Neural Rosettes”. Nat. Commun 13, 5688.
- Ho, T.C. et al. 2022. “Hydrogels: Properties and Applications in Biomedicine”. Molecules, 27, 2902.
- Sun, J. et al. 2017. “Controlled Release of BMP-2 from a Collagen-Mimetic Peptide-Modified Silk Fibroin– Nanohydroxyapatite Scaffold for Bone Regeneration”. J. Mater. Chem. B, 5, 8770–8779.
- Ning, L. et al. 2015. “Porous Collagen-Hydroxyapatite Scaffolds with Mesenchymal Stem Cells for Bone Regeneration”. J. Oral Implantol 41, 45–49.
- Goonoo, N. & Bhaw-Luximon, A. 2019. “Mimicking growth factors: role of small molecule scaffold additives in promoting tissue regeneration and repair”. RSC Adv. 9, 18124–18146.
- Siller, R. et al. 2015. “-molecule-driven hepatocyte differentiation of human pluripotent stem cells”. Stem Cell Rep 4, 939–952.
- Takasato, M. et al. 2015. “Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis”. Nature 526, 564–568.
- Wang, Q. et al. 2015. “Senar-genetic engineering of cells for drug delivery and cell based therapy”. Adv. Drug deliv. Rev 91, 125–140.
- Davoudi, Z. et al. 2021. “Gut organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery”. mar Drugs 19, 282.
- Dalby, M. J. Gadegaard N. & Oreffo R. H. 2014. “Harnessing nanotopography and integrin–matrix interactions to influence stem cell fate”. Nat. Mater 13, 558–569.
- Fluri, D A, et al. 2012. “Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures”. Nat. Methods 9, 509–516.
- National Cancer Institute (NCI). Human Cancer Models Initiative. Available en línia https://ocg.cancer.gov/programs/hcmi.
- Ettayebi, K. et al. 2016. “Replication of Human Noroviruses in Stem Cell Derived Human Enteroids”. Science 353, 1387–1393.
- Schutgens, F Clevers, H. 2020. “Human Organoids: Tools for Understanding Biology and Treating Diseases”. Annu. Rev. Orujo. Mech. Dis 15, 211–234
- 20. Vlachogiannis, G. et al. 2018. “Patient-Derived Organoids Model Treatment Response of Metastatic Gastrointestinal Cancers”. Science 359, 920–926.
- Blomme, S.A.G., Will, I 2016. “Toxicology Strategies for Drug Discovery: Present and Future”. Chem. Cap de bestiar. Toxicol 29, 473–504.
- Sàhara, D. et al. 2021. “Organoids in Tissue Transplantation”. Adv. Exp. Med. Biol 1347, 45–64.
- Singh, R.K. et al. 2015. “Derivació de Retinal Cells and Retinal Organoids from Pluripotent Stem Cells for CRISPR-Cas9 Engineering and Retinal Repair”. Investig. Ophthalmol. Vis. Sci 56, 3591.
- Verstegen, M.M.A. et al. 2025. “Clinical applications of human organoids”. Nat Med 31(2), 409-421.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











