Zelulak laborategian haztea ez da kontu berria. Hamarkadatan zehar, bi dimentsioko (2D) zelula-hazkuntzako metodoak izan dira ikerketaren oinarria eta terapia berrien garapenerako tresna nagusia. Baina... nahikoa al dira gaur egungo zientziaren erronkei erantzuteko?
Egia esan, zientzian egindako aurrerapenek agerian utzi dituzte haien mugak. Eredu horiek ez dira gai gure gorputzeko ehunen konplexutasuna guztiz imitatzeko. Ez dituzte gure gorputzeko eta funtziorako beharrezkoak diren zenbait faktore, hala nola 3 dimentsiotan antolatutako zelulaz kanpoko matrizea, ez seinale biokimiko espezifikoak edo ingurumen-estimulu egokiak [1]. Horrek mugak jartzen dizkie ikerketari eta tratamendu berrien garapenari, gorputzean gertatzen diren prozesuak ezin direlako osotasunean aztertu. Testuinguru horretan, hiru dimentsioko ereduak (3D) aurrerapen handia izan dira, organo eta ehunen ezaugarri nagusiak kontserbatzen dituztelako. Eszenatoki berri horretan, organoideak gero eta gehiago ari dira nabarmentzen etorkizun handiko tresna gisa, baina... zer dira benetan?.
Organoideak beren kabuz antolatzeko gaitasuna duten zelulez sortutako egitura tridimentsionalak dira, hau da, modu egokian bateratuta sistema bat sortzeko gai diren zelulen multzo bat. Imajinatu laborategian sortutako miniorgano batzuk. Benetako organoen ezaugarri funtzional, estruktural eta biologiko nagusiak erreplikatzen dituzte eskala txikian, eta zelulen mailatik organoetara pasatzeko antolaketara eta funtzio mailako konplexutasunera hurbiltzen dira [2]. Hala, aukera paregabeak eskaintzen dituzte: organoen garapena ulertu, gaixotasunen jatorria aztertu (minbiziena edo gaixotasun neurologikoena kasu), botika berrien segurtasuna probatu edota terapia pertsonalizatuen diseinuan aurrera egiteko aukera ematen dute [3]. Horretaz gainera, medikuntza birsortzailearen eta transplanteen etorkizuna ere irudikatzen dute; hala, gaur egun irudimenetik hurbilago dagoen hori errealitate bihurtzen dute.
Nola sortzen da organoide bat? Diseinurako funtsezko osagaiak
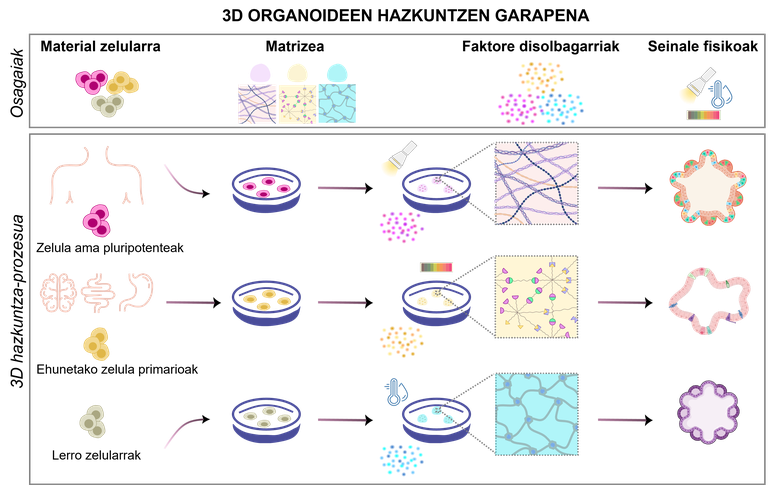
Organoideak egoki diseinatu beharreko prozesu zehatz baten emaitza dira. Esperimentuaren helburuen arabera, zelula-motak eta beharrezko osagaiak aldatuz, hainbat diseinu posible daude ikerketaren beharrei erantzuteko (1. irudia). Horretarako, funtsezkoa da lau osagai hauek kontuan izatea:
1.Material zelularra
Esperimentuaren helburuen arabera, organoideak sortzeko zelulak iturri ezberdinetatik hauta daitezke:
· Zelula ama pluripotenteak. Erabilitako hazkuntza-ingurunea aldatuz, giza gorputzeko edozein zelula-motatan berritzeko eta bereizteko gaitasuna dute. Bi mota nagusi daude: zelula ama enbrionarioak, enbrioi goiztiarretatik lortuak [4]; eta zelula ama pluripotente induzituak (iPSC), zelula helduak birprogramatuz sortuak [5].
· Jatorrizko ehunetatik isolatutako zelula primarioak. Ehun fetal edo helduetatik isolatzen dira zuzenean, eta, horrela, hobeto mantentzen dira jatorrizko propietate biologikoak. Ehunetako zelula ama helduak, zelula progenitoreak edo zelula somatiko bereiziak isola daitezke, bai ehun osasuntsuetatik, bai gaixoetatik [2].
· Zelula-lerroak. Laborategietan aurrez ezarritako zelula-lerroak erraz manipula eta genetikoki eralda daitezke, botika pertsonalizatuak probatzeko edo gaixotasun arraroak ikertzeko [6]. Hala ere, zelula-mota horiek desberdintasun nabarmenak dituzte erreplikatu nahi den in vivo ereduarekiko.
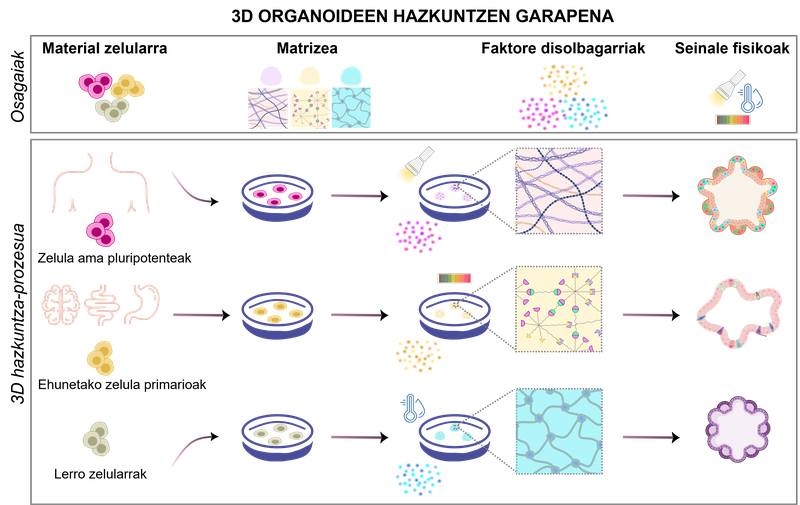
1. irudia. 3D organoideen hazkuntzen garapena. Erabilitako biomaterialen eta kondizio fisiko-kimikoen arabera, organoide-mota ezberdinak sortu daitezke.
2.Matrizea: zelulen euskarria
Organoideak seinale mekaniko eta biokimikoen bidez hazteko, garatzeko eta mantentzeko euskarria ematen du zelulaz kanpoko matrizeak. Zelulen ingurune naturala imitatzen du, zelulen hazkuntzan, desberdintzapenean eta antolaketan eragiten duten estimulu mekanikoak eta biokimikoak eskainiz. Gaur egun, hidrogelak dira gehien erabiltzen diren matrizeak: ur-kantitate handia atxikitzeko gai diren sare polimerikoak dira, eta jatorrizko ehunen oso antzeko propietate fisiko-kimikoak izan ditzakete [7]. Haien abantaila nagusia egokitzeko gaitasuna da; zurruntasuna edo porositatea organoide bakoitzaren beharretara moldatzen dute. Gainera, zelulak kanpoko estresetik babesten dituzte, eta mantenugaien eta oxigenoaren trukea ahalbidetzen dute. Hidrogelez gain, beste aukera batzuk ere aztertzen ari dira, hala nola mikroesferak eta andamio porotsuak [8, 9].
3.Faktore disolbagarriak: organoideen mantenuaren erantzule
Faktore disolbagarriak organoideen hazkuntza-inguruneko osagai garrantzitsuenetarikoak dira. Molekula horiek zelulen gainazaleko hartzaileei lotu, eta barne-seinaleak aktibatzen dituzte zenbait prozesu abiarazteko edo inhibitzeko, hala nola zelulen bereizketa eta/edo ugalketa.
Organoideen kultiboan, seinale disolbagarri horiek laborategian gehitzen dira, proteina gisa (hazkuntza-faktoreak, adibidez) edo seinaleztapen-bidezidorrak aktiba ditzaketen molekula txiki gisa batez ere [10, 11]. Baina ez da nahikoa zer gehitzen den jakitea, noiz eta nola gehitzen den jakitea ere funtsezkoa da. Gorputzean, prozesuak martxan jartzen dituzten seinaleak koordinatuta daude espazioan eta denboran. Esaterako, giza zelula ama pluripotenteak hazteko eta zenbait zelula-motaz osatutako organoideak sortzeko, bereziki garrantzitsua da aurkezpen espazio-tenporal hori [12]. Aurkezpen kontrolatu hori lortzeko, ehun-ingeniaritzako zenbait estrategia erabil daitezke, hala nola hazkuntza-faktoreak nanopartikulen barruan kapsulatzea eta zelulen gainazalean finkatzea, modu kontrolatuan askatu daitezen. Halaber, nanoteknologian oinarritutako zenbait metodo ere erabil daitezke; adibidez, nanoinprimaketa, litografia edo elektroharilketa, 3D hazkuntza zelularretan mintz basalaren antzeko gainazalak sortzeko [13-15]. Metodo horien bitartez, seinaleztapen-molekulak mintz basalean harrapatuta geratzen dira, eta modu kontrolatuan askatu.
4.Seinale fisikoak: mugimenduak ere axola du
Organoideak handitzen direnean, zaildu egiten da elikagaien hornidura eta hondakinen kanporaketa, difusioaren menpe baitaude. Horrek arazo larriak sor ditzake; adibidez, erdiguneko zelulak hiltzea. Eta zer konponbide du horrek? Mugimendua eta biorreaktoreak erabiltzea, elikagaiak eta oxigenoa uniformeki banatzeko [16]. Biorreaktoreek ingurune kontrolatu bat sortzen eta mantentzen dute zelulak baldintza optimoetan hazi eta garatu daitezen. Hala, pH-a, tenperatura, oxigenoa eta glukosa-mailak kontrolatzen dituzte, helburu bikoitz batekin: elikagaien transferentzia maximizatzea eta, aldi berean, zelulen gaineko estres mekanikoa minimizatzea [2, 16].
Organoideetan oinarritutako bioingeniaritzak paradigma berria ekarri du osasun-ikerketan, aukera eman baitu zelulen portaera modu errealistagoan aztertzeko eta aplikazio klinikoetara hurbiltzeko. 2. irudian aplikazio horietako adibide esanguratsu batzuk ikus daitezke.
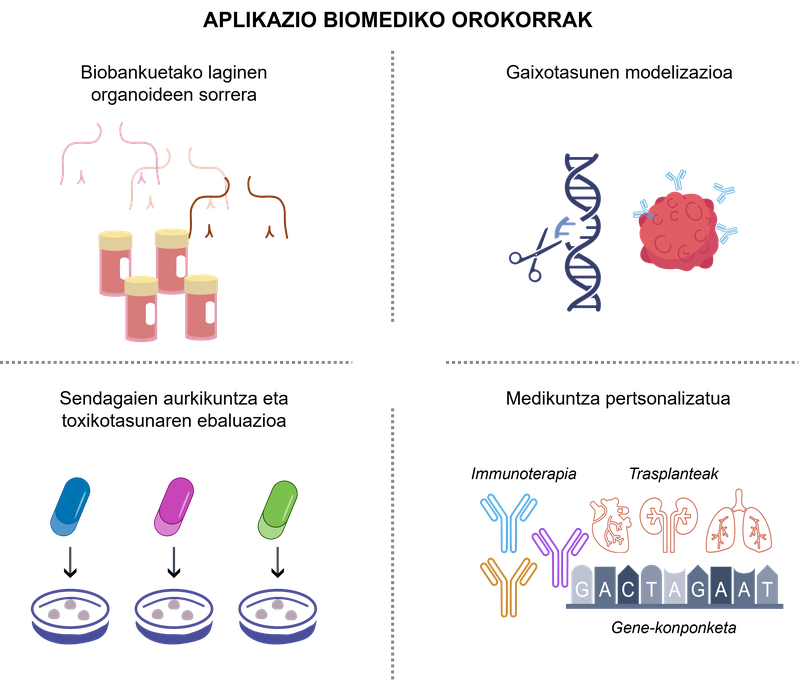
2. irudia. 3D organoideen aplikazio biomedikoak.
Biobankuen garrantzia
Biobankua gizakien lagin biologikoen eta haiei lotutako datuen bilduma sistematiko bat da, ikerketa-helburuetarako sortua eta kalitate-kontrol zorrotzekin laginak partekatzeko aukera ematen duena. Hala ere, organoideak sortzeko behar diren laginak eskasak dira, prozedura inbasiboen bidez lortzen dira eta asko aldatzen dira pertsona batetik bestera.
Organoideek aukera ematen dute gizalaginen eskasiari aurre egiteko: autoberritzeko gaitasuna, bizitza erabilgarri luzea eta ehunaren ezaugarriak denboran zehar mantentzeko ahalmena dutenez, pazienteen organoideak gorde eta berrerabil daitezke. Horri esker, tratamendu pertsonalizatuak diseinatu eta sendagaien erantzuna aurreikus daiteke, paziente bakoitzaren profil genetiko eta fenotipikoaren arabera. Adibide argia da “Human Cancer Models Initiative (HCMI)”, minbizi-organoideen biobanku globala sortzen ari den proiektua. Hala ere, badaude erronka batzuk: kostu handiak eta teknologia konplexua [17].
Gaixotasunen modelizazioa
Organoideak plataforma indartsu eta moldakor gisa agertzen dira zenbait kondizio patologiko aztertzeko, hala nola gaixotasun infekziosoak, genetikoak eta minbizia.
- Gaixotasun infekziosoak. Organoideek aukera ematen dute birus eta bakterioen portaera aztertzeko eta, hala, ostalari-patogeno interakzioak hobeto ulertu eta antibiotikoen eta birusen aurkako agenteen espezifikotasuna hobetzeko. Antibiotiko eta birusen aurkako sendagai espezifikoagoak garatzea ekar dezake horrek [18].
- Gaixotasun genetikoak. CRISPR/Cas9 eta halako beste teknologia batzuei esker, mutazio zehatz batzuk dituzten organoideak sor daitezke, gaixotasunak hobeto ikertzeko [19].
- Minbizia. Pazienteen tumoreetatik sortutako organoideek tumoreen heterogeneotasuna mantentzen dute, eta, hala, tratamendu berriak probatzeko eta jomuga terapeutikoak identifikatzeko aukera zabaltzen dute [20].
Sendagaiak azkarrago eta seguruago aurkitzeko tresna
Organoide-ereduak askoz ere eraginkorragoak dira sendagaien aurkikuntzan eta toxikotasunaren ebaluazioan, 2D hazkuntzekin konparatuta. Erantzun fisiologiko zehatzagoak eskaintzen dituzte, eta paziente bakoitzarentzako sendagai pertsonalizatuen proba ez-inbaditzaileak azkartzen dituzte. Gainera, animalien erabilera murrizten dute, ikerketa etikoago eta jasangarriago bateranzko bidean. Horrez gain, screening masiboak egiteko aukera ematen dute, denbora gutxiagoan eta kostu txikiagoarekin [21].
Medikuntza pertsonalizatuaren muga berriak gainditzea
Medikuntza pertsonalizatuari esker, osasun-arretaren paradigma aldatzen ari da; paziente bakoitzaren datu indibidualak erabiliz, prebentzio-, diagnostiko- eta tratamendu-estrategiak diseina daitezke. Testuinguru horretan, organoide-ereduen aplikazio klinikoak funtsezko papera izango du, pazienteetatik eratorritako organoideek aukera emango baitute sendagaien erantzun indibidualak aurreikusteko.
- Trasplante-terapia. Organo-emaileen organoide-ereduen garapenak eragin positiboa izango du medikuntza birsortzailean. Adibidez, izerdi-guruinen organoideak erabili dira saguen transplanteetan, eta epidermisa eta guruin horiek berriz sortzea lortu da. Hala ere, bada erronka nagusi bat, hots, egitura konplexu eta baskularizatuak sortzeko gaitasunik eza [22].
- Immunoterapia eta gene-konponketa. Organoideak eta immunitate-zelulak konbinatuz, ikertzaileek tumoreen aurkako erantzun immunitarioak azter ditzakete, tratamendu berriak garatzeko helburuarekin. Adibidez, T zelula efektoreekin egindako kokultiboak erantzun immunitario antitumoral eraginkorra sor dezake, organoide-tumore zelulen biziraupena murriztuz eta immunitate-zelulen funtzioa handituz. Bestalde, organoide-hazkuntzak erabil daitezke mutazio genetikoak konpontzeko ere. Adibideetako bat erretinako organoideen garapena izan da, zeinak bide bat ireki baitu ikusmen-galera tratatzeko etorkizuneko terapia genetikoetarako [23].
Organoideak, beraz, medikuntzaren etorkizuneko aliatu berriak dira?
Organoideak, aurrerapen zientifiko handia ez ezik, aukera paregabea dira osasuna eta gaixotasunak ulertzeko. Haien moldakortasunari, giza ehunak zelula-hazkuntza tradizionaletan baino zehaztasun handiagoz imitatzeko gaitasunari eta diagnostikoak zein tratamenduak pertsonalizatzeko aukerari esker, etorkizun oparoa zabaltzen da medikuntzan. Oraindik badaude gainditu beharreko erronka batzuk, hala nola tekniken estandarizazioa eta aplikazio kliniko zabalak lortzea, baina argi dago organoideek laborategiko kuriositatetik harago egin dutela jauzi, eta medikuntza zehatzago, etikoago eta irisgarriago baten aliatu nagusi bihurtu direla.
Imaginatu zer litzatekeen giza burmuina burezurrik ireki gabe aztertzea… Hor al dago biomedikuntzaren etorkizuna?
Bibliografia
- Clevers, H. 2016. “Modeling Development and Disease with Organoids”. Cell 165, 1586–1597.
- Zhao, Z., Chen, X., Dowbaj, A.M. et al. 2022. “Organoids.” Nat Rev Methods Primers 2, 94.
- Gómez-Álvarez, M. et al. 2023. “Addressing Key Questions in Organoid Models: Who, Where, How, and Why?”. International Journal of Molecular Sciences, 24(21), 16014.
- Thomson, J.A. et al.1998. “Embryonic Stem Cell Lines Derived from Human Blastocysts”. Science 282, 1145–1147.
- Takahashi, K., Yamanaka, S. 2006. “Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors”. Cell 126, 663–676.
- Wang, Y. et al. 2022. “Modeling Human Telencephalic Development and Autism-Associated SHANK3 Deficiency Using Organoids Generated from Single Neural Rosettes”. Nat. Commun 13, 5688.
- Ho, T.C. et al. 2022. “Hydrogels: Properties and Applications in Biomedicine”. Molecules, 27, 2902.
- Sun, J. et al. 2017. “Controlled Release of BMP-2 from a Collagen-Mimetic Peptide-Modified Silk Fibroin– Nanohydroxyapatite Scaffold for Bone Regeneration”. J. Mater. Chem. B, 5, 8770–8779.
- Ning, L. et al. 2015. “Porous Collagen-Hydroxyapatite Scaffolds with Mesenchymal Stem Cells for Bone Regeneration”. J. Oral Implantol 41, 45–49.
- Goonoo, N. & Bhaw-Luximon, A. 2019. “Mimicking growth factors: role of small molecule scaffold additives in promoting tissue regeneration and repair”. RSC Adv. 9, 18124–18146.
- Siller, R. et al. 2015. “Small-molecule-driven hepatocyte differentiation of human pluripotent stem cells”. Stem Cell Rep 4, 939–952.
- Takasato, M. et al. 2015. “Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis”. Nature 526, 564–568.
- Wang, Q. et al. 2015. “Non-genetic engineering of cells for drug delivery and cell-based therapy”. Adv. Drug Deliv. Rev. 91, 125–140.
- Davoudi, Z. et al. 2021. “Gut organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery”. Mar. Drugs 19, 282.
- Dalby, M. J., Gadegaard, N. & Oreffo, R. O. 2014. “Harnessing nanotopography and integrin–matrix interactions to influence stem cell fate”. Nat. Mater 13, 558–569.
- Fluri, D. A. et al. 2012. “Derivation, expansion and differentiation of induced pluripotent stem cells in continuous suspension cultures”. Nat. Methods 9, 509–516.
- National Cancer Institute (NCI). Human Cancer Models Initiative. Available online: https://ocg.cancer.gov/programs/hcmi.
- Ettayebi, K. et al. 2016. “Replication of Human Noroviruses in Stem Cell-Derived Human Enteroids”. Science 353, 1387–1393.
- Schutgens, F., Clevers, H. 2020. “Human Organoids: Tools for Understanding Biology and Treating Diseases”. Annu. Rev. Pathol. Mech. Dis 15, 211–234
- 20. Vlachogiannis, G. et al. 2018. “Patient-Derived Organoids Model Treatment Response of Metastatic Gastrointestinal Cancers”. Science 359, 920–926.
- Blomme, E.A.G., Will, Y. 2016. “Toxicology Strategies for Drug Discovery: Present and Future”. Chem. Res. Toxicol 29, 473–504.
- Sağraç, D. et al. 2021. “Organoids in Tissue Transplantation”. Adv. Exp. Med. Biol 1347, 45–64.
- Singh, R.K. et al. 2015. “Derivation of Retinal Cells and Retinal Organoids from Pluripotent Stem Cells for CRISPR-Cas9 Engineering and Retinal Repair”. Investig. Ophthalmol. Vis. Sci 56, 3591.
- Verstegen, M.M.A. et al. 2025. “Clinical applications of human organoids”. Nat Med 31(2), 409-421.
Cristina Romo Valera
EHUko Medikuntza eta Erizaintza Fakultateko ikertzailea, Zelulen Biologia eta Histologia Saila
Maddalen Rodriguez Astigarraga
EHUko Medikuntza eta Erizaintza Fakultateko irakaslea, Zelulen Biologia eta Histologia Saila
Noelia Andollo Victoriano
EHUko Medikuntza eta Erizaintza Fakultateko irakaslea, Zelulen Biologia eta Histologia Saila