Corrosión
1986/12/01 Erauzkin, Estibaliz Iturria: Elhuyar aldizkaria
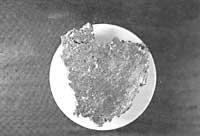
Que é a corrosión?
A maior parte dos metais atópanse en forma de óxido e sulfuro na natureza e a única maneira de conseguilos é mediante a extracción de enerxía. Por iso, estes metais atópanse nunha situación precaria e cando entran en contacto co medio ambiente tenden a retornar ao seu estado natural. Esta tendencia é a causante da corrosión.
O ferro, por exemplo, é un elemento inestable que, en estado afronto, forma óxidos de ferro hidratados en función da reacción:
2Fe + Ou 2 + 2H 2 Ou = 2FEO H 2 Ou
Estes óxidos son os denominados produtos de corrosión.
O aceiro, pola súa alta porcentaxe de ferro, sofre o mesmo proceso de oxidación.

Nalgunhas aliaxes, os produtos de corrosión únense firmemente á superficie da aliaxe e, posteriormente, ofrece protección contra posibles oxidaciones. Este é o caso dos aceiros inoxidables. Con todo, a membrana de produtos corrosivos non está moi ligada ao metal basee. Presenta irregularidades e non protexe da agresión ambiental.
En Inglaterra dise que cada 90 segundos pérdese una tonelada de aceiro debido á corrosión, que en España supón aproximadamente o 3% do PNB. A isto habería que engadir os gastos xerados polas paradas. Tamén os gastos de reposición de novas pezas, problemas de dimensionamiento en deseños, etc.
Por tanto, a importancia deste tema e a súa consecuente preocupación económica non é cuestionable.
Proceso de corrosión
A reacción de corrosión adoita estudarse como una reacción electroquímica, tendo en conta que todas as sustancias teñen diferentes potenciais electroquímicos, aínda que segundo a súa estrutura molecular recórrese a valores máis positivos ou máis negativos. As aliaxes metálicas, ao non ser sustancias puras, forman pequenos ánodos e cátodos formando pequenas pilas. O medio líquido favorecerá a transferencia de electróns. Realiza a función de electrolito oxidando o ánodo e reducindo o cátodo.
Paira poder comprobar esta reacción hai que ter en conta tres puntos:
- Aspectos estruturais do metal Natureza do medio
- Reaccións interfaciales do metal
A continuación realizarase unha breve análise dos mesmos.
- Metal Composición, elementos de aliaxe e posibles heteroxeneidades microscópicas e macroscópicas son os factores a considerar. E a presenza de tensións. Medio Analizaremos a súa natureza química (líquida ou gasosa). Moléculas oxidantes, impurezas, presión, velocidade, etc. hai que ver si hai ou non.
- Interfase do metal Cinética oxidativa do metal, natureza dos produtos corrosivos, etc. son os aspectos a analizar.
Nun primeiro momento, a reacción de corrosión pode expresarse como a seguinte reacción simple.
aA + bB = cc + dD
A sería un metal, a zona B e os produtos de corrosión C e D. Débese aclarar que os compoñentes do medio que inflúen no proceso son só algúns.
Tipos de corrosión
Loxicamente, a corrosión podería ser "seca" ou "húmida". Seco, cando a solución acuosa non participaba no proceso e húmido, nos casos inversos. Na actualidade, debido á complexidade do tema, realízase una clasificación máis ampla, tendo en conta os distintos aspectos que forman a corrosión.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia





