Corrosion
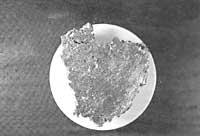
Qu'est-ce que la corrosion?
La plupart des métaux sont sous forme d'oxyde et de sulfure dans la nature et la seule façon de les obtenir est par extraction d'énergie. Par conséquent, ces métaux sont dans une situation précaire et quand ils entrent en contact avec l'environnement ont tendance à revenir à leur état naturel. Cette tendance est la cause de la corrosion.
Le fer, par exemple, est un élément instable qui, dans un état affronté, forme des oxydes de fer hydratés en fonction de la réaction:
2Fe + O 2 + 2H 2 O = 2FeO H 2 O
Ces oxydes sont appelés produits de corrosion.
L'acier, par son pourcentage élevé de fer, subit le même processus d'oxydation.

Dans certains alliages, les produits corrosifs sont solidement attachés à la surface de l'alliage et offrent ensuite une protection contre les éventuelles oxydations. C'est le cas des aciers inoxydables. Cependant, la membrane de produits corrosifs n'est pas très liée au métal de base. Il présente des irrégularités et ne protège pas de l'agression environnementale.
En Angleterre, on dit que toutes les 90 secondes une tonne d'acier est perdue en raison de la corrosion, qui en Espagne représente environ 3% du PNB. À cela il faudrait ajouter les frais générés par les arrêts. Aussi les frais de remplacement de nouvelles pièces, problèmes de dimensionnement dans les conceptions, etc.
Par conséquent, l'importance de ce sujet et sa préoccupation économique conséquente n'est pas discutable.
Processus de corrosion
La réaction de corrosion est généralement étudiée comme une réaction électrochimique, étant donné que toutes les substances ont des potentiels électrochimiques différents, bien que selon leur structure moléculaire on recourt à des valeurs plus positives ou plus négatives. Les alliages métalliques, n'étant pas des substances pures, forment de petits anodes et des cathodes formant de petites piles. Le milieu liquide favorisera le transfert des électrons. Effectue la fonction d'électrolyte en oxydant l'anode et en réduisant la cathode.
Pour vérifier cette réaction, il faut prendre en compte trois points:
- Aspects structurels du métal Nature du milieu
- Réactions interfaciales en métal
Une brève analyse de ceux-ci sera ensuite effectuée.
- Métal Composition, éléments en alliage et hétérogénéités microscopiques possibles et macroscopiques sont les facteurs à considérer. Et la présence de tensions. Milieu Nous analyserons votre nature chimique (liquide ou gazeuse). Molécules oxydantes, impuretés, pression, vitesse, etc. il faut voir s'il y en a ou non.
- Interface du métal Cinétique oxydante du métal, nature des produits corrosifs, etc. sont les aspects à analyser.
Dans un premier temps, la réaction de corrosion peut être exprimée comme la réaction simple suivante.
aA + bB = cC + dD
A serait un métal, la zone B et les produits de corrosion C et D. Il faut préciser que les composants du milieu qui influencent le processus ne sont que quelques-uns.
Types de corrosion
Logiquement, la corrosion pourrait être "sèche" ou "humide". Sec, quand la solution aqueuse ne participait pas au procès et humide, dans les cas inverses. Actuellement, en raison de la complexité du sujet, une classification plus large est réalisée, en tenant compte des différents aspects qui forment la corrosion.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian









