Novela química para los que estudiaron la estructura atómica y el funcionamiento de los ribosomas
2009/10/07 Kortabitarte Egiguren, Irati - Elhuyar Zientzia
Tres investigadores recibirán este año el premio Nobel de Química por estudiar la estructura y funcionamiento de los ribosomas a nivel atómico. Venkatraman Ramakrishnan, EEUU, Thomas A. Steitz y Ada E de Israel. Los ganadores son Yonath.
Los ribosomas participan en la síntesis de proteínas. El código genético necesario para la síntesis de proteínas es recogido mediante un ARN mensajero, que forma cadenas de proteínas con esta información y con los aminoácidos aportados por las moléculas de ARN de transferencia. Son las proteínas imprescindibles para vivir.
Cristalografía de rayos X

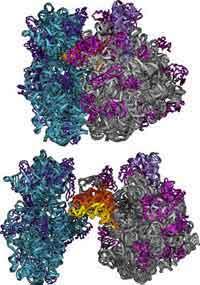
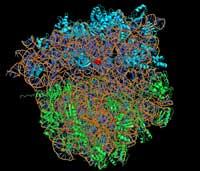
Para conocer el funcionamiento de una molécula es imprescindible conocer con precisión su estructura atómica. Lo mismo ocurre con estructuras más complejas que las moléculas, como los ribosomas. En este sentido, Ada E comenzó a finales de los años 70. Yonath a este trabajo. Es decir, al estudio de la estructura atómica de los ribosomas. Para ello utilizó la cristalografía de rayos X. Esta técnica consiste en la emisión de rayos X contra ribosomas cristalizados. Estos rayos X al chocar con el cristal del ribosoma se dispersan, representando millones de puntos en el ojo de las cámaras digitales o en el detector CCD. Analizando esta imagen compuesta por millones de puntos, los investigadores pueden saber dónde se sitúa cada átomo en el ribosoma. Sin embargo, los ribosomas son estructuras complejas formadas principalmente por proteínas y ácidos nucleicos, cuya estructura atómica no es tarea fácil de determinar. Se compone de dos subunidades, una subunidad pequeña y una subunidad grande. Cada una de estas subunidades tiene miles de átomos. D. Ada Yonath quería conocer la ubicación exacta de cada uno de ellos.
Para lograr este objetivo se empezaron a cristalizar varios ribosomas y a obtener estas imágenes formadas por puntos. A principios de la década de los 90 pudo observar la posición de los átomos del cristal de un ribosoma. Sin embargo, se encontró con un problema: para conocer con precisión la estructura atómica del ribosoma era necesario conocer el ángulo de fase de cada rayo dispersado. De hecho, esta información matemática nos indica, entre otras cosas, la posición de los átomos en el cristal.
Un método habitual para conocer estos ángulos de fase es la inmersión de estos cristales en átomos pesados como el mercurio. Estos átomos pesados se adhieren a la superficie del cristal y, por lo tanto, comparando las imágenes formadas por átomos pesados y sin átomos pesados, los científicos conocen estos ángulos de fase. Sin embargo, dado que los ribosomas son moléculas grandes, la determinación inmediata del ángulo de fase al unirse a ellos los átomos pesados era prácticamente imposible.
Thomas Steitz solucionó el problema. Éste utilizó varias imágenes de los ribosomas recogidos con un microscopio electrónico y determinó la disposición de los átomos de los ribosomas. Desgraciadamente, las imágenes no tuvieron una resolución muy buena y no pudieron identificar a los átomos individualmente. Sin embargo, con la ayuda de estas figuras y de los átomos pesados, determinó los ángulos de fase.
Una vez superado el problema del ángulo de fase, sólo quedaba mejorar los cristales y aumentar la recogida de datos para mejorar la precisión de la imagen. Los tres premiados de este año lo lograron de inmediato. En agosto y septiembre de 2000 se presentaron diversas estructuras cristalinas que permitían interpretar la estructura atómica. Thomas Steitz consiguió determinar la estructura atómica de la gran subunidad del ribosoma del arqueólogo Haloarcula marismortui. D. Ada Por su parte, los investigadores Yonath y Venkatraman Ramakrishan obtuvieron la estructura de la pequeña subunidad del ribosoma de la bacteria Thermus thermophilus. Por tanto, vieron que era posible determinar a nivel atómico la estructura y funcionamiento de los ribosomas.
Búsqueda de nuevos antibióticos
Por otro lado, el conocimiento exhaustivo de la estructura y funcionamiento del ribosoma abre nuevas vías. De hecho, muchos antibióticos se asocian al ribosoma bacteriano, impidiendo su producción proteica. Además, muchas de estas bacterias han desarrollado resistencia a estos fármacos. Por tanto, es imprescindible encontrar nuevas vías.
En el futuro, y tras los pasos dados por estos tres investigadores, se podrán diseñar mejores antibióticos en la lucha contra las bacterias. De hecho, los tres se han centrado en investigar cómo se asocian los antibióticos a los ribosomas y ya existen organizaciones que utilizan las estructuras de los ribosomas para desarrollar nuevos antibióticos.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia