Luz gratis

A fluorescencia e a fosforescencia non son o mesmo, pero a diferenza non é grande. En ambos os casos, a materia absorbe e emite luz. No caso da fluorescencia isto ocorre en moi pouco tempo, nalgúns microsegundos. No caso da fosforescencia, o tempo que pode abarcar este proceso é moi amplo: milisegundos, minutos e mesmo horas. Por iso, no caso da fosforescencia, aínda que non existan outras fontes de luz, a materia pode seguir emitindo luz.
Luz propia
Plinio Zaharra falou sobre unhas pedras preciosas con luz propia. Pero XVII. A principios do século XX, outra pedra singular espertou o verdadeiro interese científico. Vincenzo Casciarolo, zapateiro e alquimista, atopou nas proximidades de Bolonia una pedra de sulfato de bario que logo se coñecería como a pedra boloñesa. E alí descubriu que si se mantiña á luz do sol emitía despois una luz estraña na escuridade. Isto espertou a imaxinación dos alquimistas da época. E é que, naquela época, os alquimistas buscaban a pedra dos filósofos que serviría paira facer ouro, e por suposto, una pedra máxica destas características era moi esperanzadora.
Aínda que non tivo éxito como pedra dos filósofos, a curiosidade pola pedra bolónica non desapareceu. O propio Galileo tamén participou nos debates científicos sobre esta pedra. Por exemplo, cando Fortunius Licetus escribiu que a luz da lúa era a mesma que a da pedra bolónica, Galileo opúxose alegando que a luz da lúa era a luz reflectida do sol.

Sobre esta pedra realizáronse multitude de investigacións, á vez que moitos investigadores foron descubrindo outras sustancias de similares propiedades. Todas se volvían luminosas, despois da luz ou quentadas, etc. Por iso denominóuselles phosphés, é dicir, luminosos ou porta-luz. E hoxe en día coñecemos como fosforescencia aquel fenómeno máxico observado polo zapateiro Casciarolo na pedra bolónica.
A pesar de tratarse dun fenómeno moi similar á fosforescencia, a fluorescencia foi atopada moito máis tarde: XIX. No século XX. Aínda que por primeira vez vírono nunha solución de clorofila, Sir George Gabriel Stokes (a quen se debe boa parte do que hoxe sabemos sobre este tema) tomou o nome do fenómeno da fluorita.
A nivel atómico
Paira comprender estes dous fenómenos é necesario descender ao nivel dos átomos. Basicamente, cando un fotón --ou radiación electromagnética - toca un átomo, este toma a enerxía do fotón e excítase. E cando o átomo volve ao seu estado inicial relaxado, emite outro fotón, normalmente de menor enerxía.

Supóñase que un electrón excitado ha pasado do nivel básico de enerxía S 0 ao nivel S 1. Pero dentro destes principais niveis enerxéticos hai outros niveis. Así, por exemplo, é posible que o electrón suba até o terceiro nivel de S 1. Inmediatamente, este electrón tenderá a descender ao nivel mínimo de S 1 e perderá algo de enerxía neste camiño en forma de calor. A continuación, o electrón baixará ao nivel básico (S 0) e si nese camiño a enerxía que perde salgue como fotón, estaremos ante un caso de fluorescencia.
O resultado deste proceso é que o átomo que recibe a radiación dunha determinada lonxitude de onda absorbe esa primeira radiación e emite una radiación de maior lonxitude de onda, e por tanto de menor enerxía. Esta é a base da fluorescencia.
Os niveis enerxéticos dos átomos son discretos e requiren una cantidade determinada de enerxía paira pasar dun a outro. Por iso, só absorben fotóns con esta cantidade de enerxía. Por tanto, os materiais fluorescentes e fosforescentes emiten luz só cunha radiación dunha determinada lonxitude de onda, e á súa vez, a luz que emiten será dunha determinada lonxitude de onda. Ou, máis concretamente, dun rango concreto de lonxitudes de onda. De feito, dentro do nivel enerxético básico non sempre caen os electróns ao mesmo nivel. E, por tanto, non toda a radiación emitida será da mesma lonxitude de onda. A lonxitude de onda na que se produce a absorción e a emisión depende dos compoñentes e do estado do material.

Como a radiación emitida é menor que a absorbida, para que a emitida teña un espectro visible, normalmente os átomos deben aspirar aos raios ultravioleta. Por iso, a fluorescencia adoita aparecer na maioría dos casos baixo radiación ultravioleta. Con todo, o absorbido e o emitido tamén poden pertencer ao mesmo espectro, e ás veces tamén custa separalos.
Vía prohibida
No caso da fosforescencia o proceso é moi similar. Pero os electróns excitados quedan 'atrapados' noutra situación especial. De feito, neste caso, dise que o paso deste peculiar estado a un nivel de enerxía básico está cuanticamente prohibido. Isto non significa que non se pase, pero a probabilidade é moito menor. Por iso, o proceso alárgase e, tras eliminar a fonte de radiación, o material fosforescente segue emitindo luz.
Con todo, a maioría dos fosforescentes son emisores relativamente rápidos que emiten luz nuns milisegundos. No caso doutros, con todo, o proceso pode alargarse moito: minutos e mesmo horas, polo que adoitan ser materiais que dan luz no escuro. Este é o caso da pedra boloñesa. E iso é tamén o que ocorre nas agullas e números de moitos reloxos, ou paira pegarse no teito nesas estrelas e planetas, etc.
Pero a fosforescencia ten outra aplicación moi utilizada. O que vemos nas televisións convencionais ou nas pantallas dos computadores de sobremesa é precisamente a fosforescencia, se estas pantallas funcionan por medio dun tubo de raios catódicos. Nestas pantallas utilízanse tres compoñentes fosforescentes paira crear imaxes coloreadas: o sulfuro de zinc combínase co cobre e o aluminio, obtendo un compoñente de cor verde; paira o azul, o sulfuro de zinc mestúrase cun pouco de prata; e por último, a cor vermella obtense activando o sulfuro de óxido de itrio co europeo.

En casa, discoteca e laboratorio
A fluorescencia é, na actualidade, totalmente domesticada. De feito, é moi habitual o uso de tubos fluorescentes paira a iluminación de calquera tipo de edificio. Estes tubos conteñen mercurio no seu interior e as paredes do tubo un recubrimiento fluorescente polo seu interior. Cando se produce una descarga eléctrica entre os electrodos do tubo, os electróns excitan aos átomos de mercurio e estes emiten radiación ultravioleta.
Esa radiación non é visible, e si só iso ocorrese, non veriamos a luz. Pero esta radiación ultravioleta emitida polos átomos de mercurio excitados excita á súa vez aos átomos do revestimento fluorescente do tubo, que emiten a luz visible que salgue do tubo fluorescente.
E a cadea de átomos que se excitan pode ser máis longa. De feito, outras lámpadas fluorescentes utilízanse simultaneamente paira producir fluorescencia. Son similares aos tubos fluorescentes convencionais, pero con diferente cobertura, e emiten un pouco de luz visible e, sobre todo, una radiación ultravioleta próxima, chamada “luz negra”.
Esta radiación ultravioleta próxima adoita ser dunha lonxitude de onda superior a 350 nm, moi próxima ao espectro visible, polo que non ten efectos adversos sobre os raios ultravioletas de menor lonxitude de onda. Estas lámpadas utilízanse paira resaltar materiais fluorescentes na escuridade. Por exemplo, son habituais nas discotecas paira inducir a fluorescencia do poliéster que adoita estar presente nos tecidos brancos.
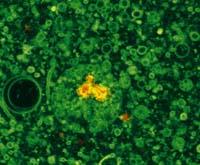
Ademais de en casa e discoteca, nos laboratorios tamén é importante a fluorescencia. A fluorescencia ten moitas aplicacións na ciencia. É moi utilizado en bioquímica e medicamento paira detectar moléculas, células ou tecidos. Algunhas moléculas poden presentar fluorescencia propia, pero en moitos casos utilízanse marcas fluorescentes --fluoroforos- paira marcar o que se pretende detectar.
Por exemplo, mediante a adición dun fluoroforo aos anticorpos, pódese localizar nunha mostra o antígeno deste anticorpo. Paira iso utilízanse microscopios de fluorescencia. Estes microscopios iluminan a mostra con raios ultravioleta que permiten a observación visual da fluorescencia ou mediante un monitor.

A fluorescencia ten cada ano máis aplicacións a nivel científico. Pero habemos visto que na vida cotiá a fluorescencia e a fosforescencia son máis comúns do que poderiamos pensar nun principio. Se estás a usar un ou os dous paira ler, non sei, pero paira escribir este artigo os dous foron imprescindibles.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











