Prions : protéines pathogènes
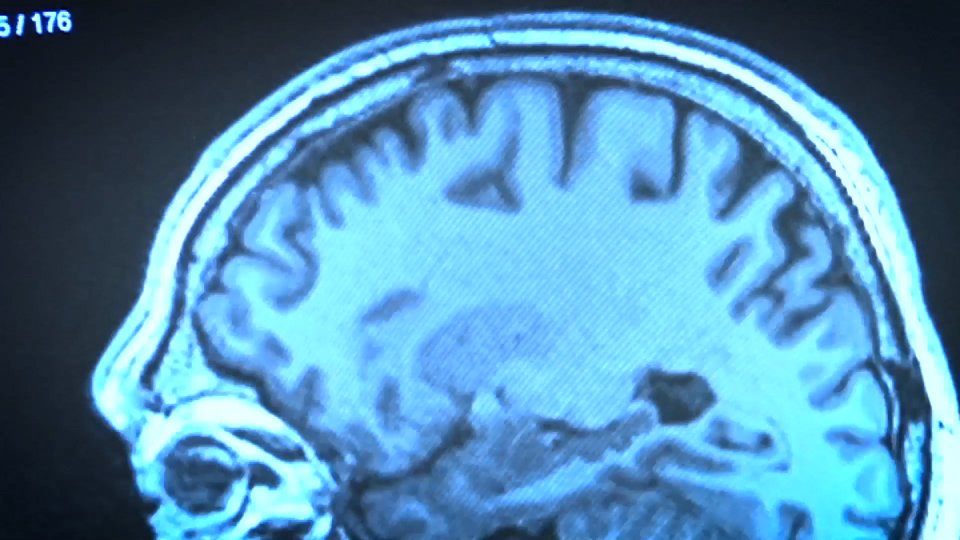
Ce sont des maladies appelées encéphalopathies spongiformes, qui endommagent le cerveau et dont la source se trouve dans les protéines endommagées, les prions. Ils peuvent être développés non seulement par les animaux, mais aussi par les humains.
Jusqu'à présent, les lapins étaient considérés comme l'un des rares mammifères à résister aux maladies causées par les prions. Mais les dernières nouvelles disent le contraire. D'après les résultats du centre de recherche CICbioZONA, même les lapins ne sont pas à l'abri de ces maladies. Ce sont là les étapes actuelles de l'étude des prions.
Il y a plus d'une décennie, des images comme celle-ci ont été vues dans le monde entier. Les bovins et les moutons, d'abord, et les humains, ensuite, ont développé des maladies qui endommageaient le cerveau. Il s'agissait de maladies appelées encéphalopathies spongiformes causées par des prions, c'est-à-dire des protéines pathogènes reproductibles qui causent la maladie.
L'origine des prions reste inconnue des chercheurs.
Des étapes ont été réalisées dans le CIC bioSITE pour une meilleure connaissance. Avec des protéines, ils savent qu'ils n'ont pas d'ADN. C'est pourquoi il est si difficile de le détruire. Mais il y a beaucoup de questions sans réponse.
Un prion contamine une protéine saine par simple contact et la convertit en un prion pathogène, mais on ne sait toujours pas pourquoi ce prion est produit, comment se produit le contact pour infecter les autres protéines et quels paramètres sont nécessaires pour que la transformation se produise.
JOKIN CASTILLA; CIC bio-COMPLEXE: La protéine qui a un mauvais pli, c'est-à-dire une mauvaise protéine, est capable de se lier à d'autres protéines dans le cerveau. Une fois collé, il provoque un changement de structure chez eux et les transforme en mauvaises protéines. Ces mauvaises protéines ont le pouvoir de contaminer les autres. Dans ce processus de multiplication, la mauvaise protéine s'accumule et crée la maladie. Mais nous ne savons pas encore quel mécanisme fait apparaître la pathologie.
La maladie des vaches folles chez les bovins, les moutons scrapies ou la maladie de Creutzfeldt-Jacobs chez les humains sont les maladies les plus connues causées par les prions.
Les maladies prioniques chez les animaux et les humains ne sont pas toujours liées. Il a été démontré qu'elle peut être contaminée dans certains cas, comme l'encéphalopathie spongiforme bovine. Mais dans d'autres, comme la scrapie des moutons ou l'érosion chronique des cerfs, il n'y a pas de contamination. Cela ne signifie pas que cela ne peut pas se produire avec le temps.
JOKIN CASTILLA; CIC bio-COMPLEXE: Nous parlons tous de la grippe aviaire ou de la grippe porcine et nous savons que ces agents évoluent. Les prions ont le même potentiel d'évolution, et c'est là que se trouve la possibilité d'expliquer un prion ayant une plus grande capacité à infecter d'autres animaux ou l'homme.
Dans la plupart des cas, les maladies prioniques se produisent soudainement, mais 10% sont génétiques, car elles sont associées à une mutation qui se produira dans le gène de la protéine qui deviendra un prion.
C'est le cas de l'insomnie familiale mortelle et 40% des cas dans le monde sont donnés au Pays Basque. Cette maladie génétique survient soudainement et provoque une insomnie persistante chez le patient. La personne arrive à un état d'épuisement, ce qui entraîne la mort en quelques mois.
Trouver les mécanismes des prions responsables de ces maladies est essentiel pour lutter contre ces maladies.
JOKIN CASTILLA; CIC bio-COMPLEXE: Les principaux travaux de recherche visent à déterminer le mécanisme par lequel les prions fonctionnent. Notre laboratoire étudie précisément ce qui donne à un prion la capacité de dépasser les limites humaines, par exemple pourquoi un prion bovin est capable de contaminer l'homme et un prion de brebis non. C'est ce que nous essayons de découvrir. Si nous le savions, nous pourrions bloquer le pouvoir de multiplication des prions en imitant la nature. Et nous concevons des médicaments pour la thérapie.
Les résultats de ces études seraient également utiles, par exemple, pour les maladies d'Alzheimer et de Parkinson, dont les mécanismes sont similaires à ceux des maladies prioniques.
JOKIN CASTILLA; CIC bio-COMPLEXE: Dans le cas de la maladie d'Alzheimer, il existe une protéine appelée bêta-amyloïde, qui est également mal repliée et a le potentiel de se lier et de se plier mal aux autres protéines. C'est comme ça que les plaques d'Alzheimer se forment. C'est un mécanisme prionique.
Dans le cas de Parkinson, bien qu'il s'agisse d'une maladie d'origine différente, il a été observé qu'une fois les problèmes de base résolus, les patients ont tendance à avoir une forme de parkinson tardif, qui est liée à une protéine appelée alpha-synucléine. Cette protéine a un comportement similaire à celui des prions en termes de capacité de propagation.
Malheureusement, il n'existe actuellement aucun remède contre les maladies prioniques. Des progrès sont faits avec certains anticorps, mais il n'est pas très développé. Les chercheurs pensent qu'il faudra attendre au moins cinq ans pour obtenir un traitement efficace.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian