Que é iso da entropía?
As dúas leis simples da termodinámica constrúen a base da disciplina, pero a entropía sempre crea o maior obstáculo de comprensión. Aínda que o concepto de enerxía é coloquialmente accesible, a entropía ten unha carga semántica confusa. Este texto aclara o significado técnico de ambas as leis e ofrece a clave para entender a entropía como propiedade.

Hai xa uns anos que volvo cunha materia que ten como base a disciplina da Termodinámica. Dou clases nun curso de máster. Os alumnos son, por tanto, persoas que obtiveron o título de enxeñeiro. É dicir, ao comezo do curso, cando facemos un repaso da materia de grao que equivale ao curso de máster, os conceptos expostos en clase deberían facerse tan comprensiblemente intuitivos. Polo menos así é ata que tropezamos coa pedra de sempre. Ao chegar á conta da entropía, acabouse. Anabasa anual: ceños escuros, moitas preguntas, máis dúbidas. Ao final, agárrome á forma práctica de sempre saír da comporta. É dicir, prestar atención aos cálculos e restar importancia á comprensión do concepto.
Son consciente de que en realidade debería pór gran parte da carga nas posibles deficiencias das miñas capacidades de comunicación. Sospeito, con todo, que o resto do problema ten que ver con outro factor, a forma habitual en que se explican os fundamentos da Termodinámica.
Só usamos dúas leis en toda a lección. Estas leis teñen un carácter empírico. Noutras palabras: naquel século XIX da súa formulación, non se deduciron doutros principios, senón que foron deducidos directamente dos casos observados na experimentación cotiá.
Hoxe, doutra banda, son moitos os desenvolvementos que sufriu a incipiente disciplina que naquela ocasión denominouse Termodinámica, e os conceptos propios que deu a luz quedaron limitados ao campo da denominada “Termodinámica Clásica”. Estoutros desenvolvementos deron a luz novas disciplinas: “Termodinámica estatística”, “Termodinámica cuántica”, “Termodinámica irreversible”, entre outras.
Tal e como se desprende destas designacións, aumentou a complexidade dos fenómenos estudados, así como a formulación de teorías e investigacións. Con todo, a proliferación de disciplinas e o incremento da complexidade dos fenómenos non lograron alterar o carácter básico das leis citadas. Calquera que sexa o fenómeno estudado, ou sexa a teoría formulada, confirmouse que ambas as leis deben cumprir o que se lles impuxo. É a importancia de comprendelos e de interiorizarlos.
Que din esas leis? Se as falo con palabras sinxelas son moi fáciles de comprender, e aproveito para explicalas tamén en clase. Primeira lei: a enerxía non se crea nin se destrúe, senón que se transforma. Ou usando un termo máis técnico dalgunha maneira: a enerxía consérvase. Segunda lei: A natureza (en maiúsculas) é un casino, polo que sempre gana. Noutras palabras, podemos interpretar o noso intercambio coa Natureza como un continuo intercambio de enerxía, e no xogo que supón este sentido, a Natureza termina por adquirir toda moeda de enerxía. Mesmo dunha terceira maneira: a cantidade de enerxía que nos pode ser útil ou explotable vai diminuíndo constantemente. E o mellor medidor desta diminución é outro concepto físico que aumenta de forma paralela: a entropía.
O concepto de enerxía é moi intuitivo. Usámolo no día a día, e usámolo en situacións que teñen diferentes significados ou significados. É un concepto polisémico tan estendido. A lei de conservación da enerxía ten un status similar: cantas veces ouviriamos esta alocución de non xeración, non destrución, senón de transformación? É máis, o tema da conservación é moi coñecido noutras disciplinas diferentes á Termodinámica: por exemplo, a conservación da cantidade de movemento e do momento angular na Mecánica, ou a conservación da masa en sistemas non relativistas.
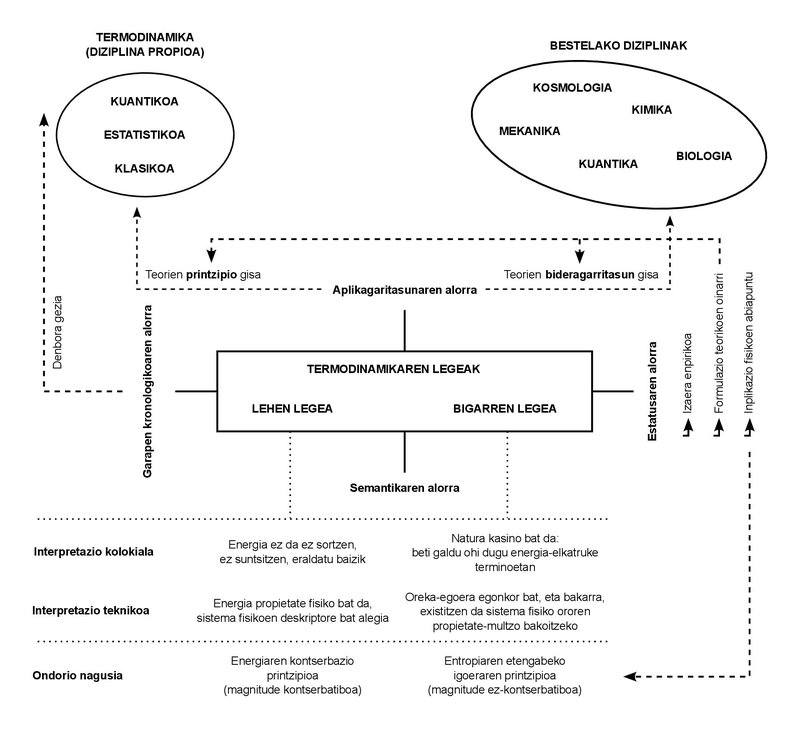
os conceptos de “conservación” e “enerxía”, por tanto, sonnos totalmente accesibles. Conseguiron facer un percorrido desde a linguaxe técnica até o coloquial. Non é pouco. Con todo, a noción de entropía tivo máis obstáculos para iso. Non se pode dicir que non sexa coñecido, aínda que sexa dalgunha maneira máis misterioso que os outros dous mencionados. Con todo, a miña carraca ten a maior tensión precisamente co significado común e compartido da entropía. Como me ocorre cos alumnos, son consciente de que todo aquel que se atopou con este concepto relaciónao tamén coa ignorancia e a desorde.
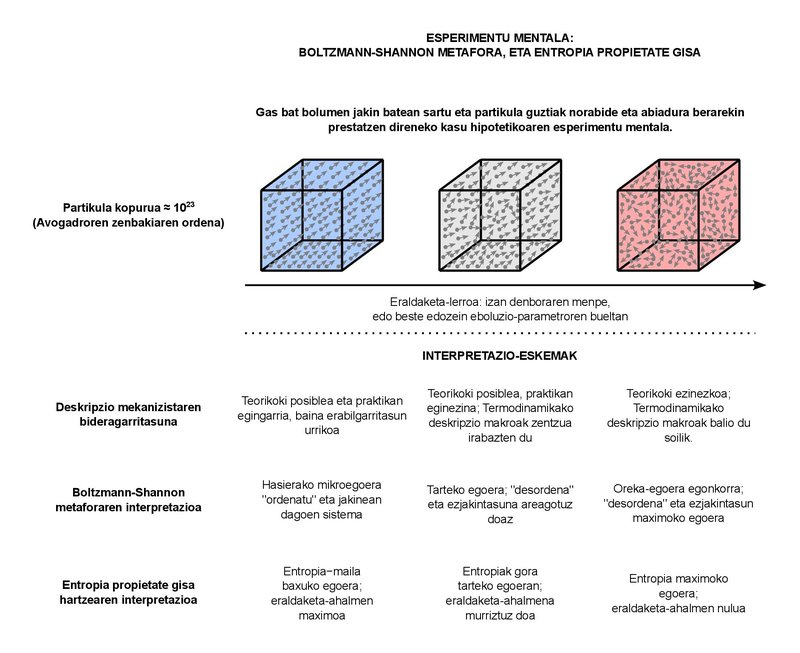
Esta perturbadora carga semántica é moi comprensible. De feito, o obxectivo da Termodinámica clásica é describir o comportamento macroscópico dos sistemas formados por numerosas partículas. Cantas partículas son “abundantes” pero? Por exemplo, na lección na que son profesor, botemos en conta que nos sistemas típicos que estudamos tomamos fluídos de moi poucos litros e quilogramos. Sexa cal for a sustancia que tomemos como fluído, o número de partículas que podemos atopar nos sistemas destes tamaños é da orde do número de Avogadro, é dicir, uns 10 23. Basicamente, o número de Avogadro representa o número de partículas que hai nun mol de calquera sustancia. Podemos equiparar o concepto de mol ao de quilogramo (que é o que cuantifica a sustancia), pero é algo máis básico en si mesmo. De feito, numerosos fenómenos mensurables de comportamento físico de moitas sustancias son proporcionais ao número de partículas (e por tanto aos moles), non tanto á masa. 10 23 partículas son suficientes. Teña en conta que a orde da poboación mundial está a achegarse a ao redor de 10 10. En termos sinxelos, aínda que teriamos tantos planetas como habitantes hai no mundo, a poboación (10 20) almacenada en todos eles estaría un pouco afastada de chegar ao número de partículas que aínda se atopan nun mol. Polo menos un número enorme. Que podemos dicir do comportamento macroscópico destes sistemas? Esta é basicamente a pregunta á que responde a Termodinámica clásica. Os conceptos de “presión” ou “temperatura” que manexamos no día a día forman parte da resposta dada á pregunta.
Non é de estrañar, por outra banda, que os sistemas con número de partículas desta orde presenten un gran caos. cada unha destas partículas, que son aproximadamente 10 23, é completamente imposible de seguir, polo que non podemos proporcionar unha descrición mecanicista completa do sistema. No seu lugar, utilizamos os conceptos de Termodinámica estatística baseados na Física estadística para combinar de forma axeitada os dous enfoques, a macro e o micro. Deberiamos situar aí a metáfora da desorde ao redor da entropía. Nun esforzo por xustificar con conceptos de visión micro este aumento constante de entropía que se verifica no comportamento macro.
O fundamento da metáfora debémosllo ao físico austriaco Ludwig Boltzmann, que no núcleo di que, en realidade, estas 10 23 partículas poden estar organizadas de moitas maneiras. Podemos denominar a cada modo de organización como “microestado”. Un sistema macroscópico pódese representar, en principio, completamente definido. É dicir, está nunha de todas as microsituaciones posibles. Cando o sistema sofre unha transformación, fánselle fisicamente accesibles múltiples microestados compatibles co enfoque macroscópico. Todos estes microestados son complementarios, é dicir, fisicamente posibles, por unha banda, e inseparables desde o punto de vista macroscópico, por outro. Dado que o aumento dos posibles microestados é igual á tendencia constante de aumento da entropía, Boltzmann formulou a súa definición de entropía baseándose na proporcionalidade entre ambos. Así, a entropía sería a indisolubilidad macroscópica entre os modos cada vez máis numerosos de organización das partículas. Ese é a desorde.
Décadas máis tarde, o enxeñeiro Claude Shannon engadiu o concepto da ignorancia á metáfora da desorde. Shannon está a levar a cabo unha teorización dos sistemas de comunicación e, ao formular matematicamente a cantidade de información que conteñen as mensaxes, atópase coa expresión aparente da entropía, utilizada na Termodinámica. Relacionou o aumento de entropía nun sistema coa perda de información sobre o mesmo. E, xunto coa visión de Boltzmann, desenvolveuse así a acepción común coa que nos atopamos na actualidade: a entropía, magnitude que expresa o grao de ignorancia e desorde ao redor dos sistemas físicos.
Tras este breve percorrido semántico, só dous puntos. Primeiro: os significados coloquiais (enerxía, conservación, entropía) dos conceptos expresados deben utilizarse con cautela. Aínda que poden reflectir adecuadamente a idea crave dos seus equivalentes técnicos, poden deixar fose importantes matices. E a segunda: O mesmo ocorre coas expresións usuais das dúas leis da termodinámica, que embazan dalgún modo a carga técnica que soportan. De feito, a conservación da enerxía non é unha formulación da primeira lei, senón unha das súas consecuencias. De feito, o sentido abstracto da primeira lei é que a enerxía pode ser definida como propiedade física. Ese sería o seu significado máis profundo.
Coa segunda lei pasa da mesma maneira. A imaxe do casino pode ser dalgunha maneira didáctica, pero non é do todo técnica. Ao expresalo formalmente, a segunda lei só codifica a existencia de estados estables de equilibrio. O feito empírico de que todo sistema tende ao equilibrio. Pois ben, entre todos os estados de equilibrio, a segunda lei di que para cada valor que toma o conxunto de magnitudes que describe o sistema hai un único estado de equilibrio estable. A consecuencia directa da combinación de ambas as leis é que a magnitude entropía, como enerxía, é unha propiedade que indica que un sistema chegou ao seu estado estable de equilibrio, no que a entropía reflicte o valor máximo que pode adquirir.
A enerxía e a entropía, por tanto, non son tan diferentes. Ambas son propiedades físicas, é dicir, magnitudes que se poden utilizar para describir o estado físico de calquera sistema. As máis elementais, por certo, porque se derivan da maneira máis directa de ambas as leis. E, como propiedades, están definidas de maneira axeitada para todos os estados do sistema, xa sexan estados de equilibrio ou fóra de equilibrio, estables ou non. É máis, e do mesmo xeito que ocorre co concepto de enerxía, a entropía non é unha magnitude estadística ou informacional, aínda que nestes campos asuma as súas propias manifestacións.
Como propiedade, a enerxía cuantifica as capacidades de intercambio que ten un sistema, mentres que a entropía céntrase na capacidade de transformación. A maior entropía, menor poder de transformación. Ao chegar ao estado de equilibrio estable, a entropía tomará o valor máximo e a capacidade de transformación será nula. Máis que unha desorde máxima e un descoñecemento total, teremos unha orde perfecta e todo o coñecemento do sistema: de feito, non poderá estar nun estado de equilibrio diferente ao que se está.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











