La clé du pliage des protéines peut être dans la structure initiale
La question fondamentale des biochimiques est de savoir comment les protéines sont pliées? Beaucoup de chercheurs sont derrière la réponse. Les réactions chimiques dont le corps a besoin sont produites par des protéines. Et pas seulement cela. Certaines ont des propriétés mécaniques spéciales, flexibilité, rigidité ou capacité de support. D'autres sont transporteurs, portent des molécules d'un endroit à l'autre ou agissent comme des portes, introduisent des substances dans la cellule et en extraient d'autres. D'autres sont des médecins, attrapent des bactéries externes et "mangent".
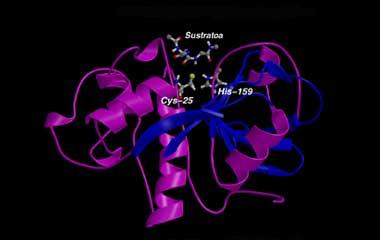
Cependant, ce personnel n'est pas indestructible. Ce sont de longues chaînes formées d'acides aminés et pour bien remplir leur travail, la chaîne doit obtenir une position précise. Si vous ne le faites pas correctement, vous ne pouvez pas faire votre travail et des problèmes peuvent survenir. Les chaînes longues peuvent avoir beaucoup de plis, mais une seule a une activité biologique. Une protéine contient des centaines d'acides aminés, de sorte que l'ordinateur le plus puissant ne pourrait pas étudier toutes les possibilités. Cependant, pendant la formation de protéines dans les cellules, celles-ci se replient efficacement. C'est un mystère sur la façon dont la nature invente.
Les scientifiques savent que la bonne apparence est limitée par deux facteurs. La première est la relation entre les parties éloignées de la chaîne. Ces liaisons sont réalisées par des acides aminés spéciaux qui sont connus. La seconde est le passe-temps de groupes d'acides aminés situés dans la structure finale. Dans les protéines qui doivent fonctionner dans le cytoplasme de cellules (eau), les acides aminés qui doivent entrer en contact avec le milieu sont urinaires. La "peau" de protéine doit être hydrophile.
Malgré tout, les scientifiques ne disposent pas d'une méthode pour dire comment une certaine chaîne d'acides aminés est tolérée. Pour le savoir, vous devez le voir de manière expérimentale, mais ce processus nécessite dans la plupart des cas une recherche d'années pour une seule protéine. C'est pourquoi il y a beaucoup de groupes qui étudient ce sujet. Les portes du Prix Nobel seront facilement ouvertes à tous ceux qui trouveront la réponse.
L'un de ces équipements est dirigé par le biochimiste de Zurich Wilfred van Gunster. Gunsteren étudie les pliages de petites portions de protéines formées par sept acides aminés. Ses résultats sont encourageants. Une bonne analyse des structures non pliées réduit considérablement le nombre d'options disponibles dès le début. Cela réduit l'alimentation du logiciel et facilite la simulation de pliage.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian











