Nanomédicine comme traitement du cancer du sein
Le cancer du sein est la maladie qui provoque le plus de décès chez les femmes. Les thérapies actuellement utilisées pour lutter contre le cancer sont principalement la chimiothérapie et la radiothérapie [1, 2], et sont des techniques très envahissantes qui provoquent de nombreux effets indésirables [3]. La chimiothérapie conventionnelle affecte tout l'organisme, endommageant les cellules cancéreuses et saines. Par conséquent, la dose de chimiothérapie est limitée à un traitement très toxique. Les nanoparticules peuvent être des ressources thérapeutiques adéquates pour surmonter ce manque de spécificité de la chimiothérapie conventionnelle [4].
Ainsi, en utilisant des nanoparticules, il est possible de libérer le médicament contre le cancer sur le site d'application ou de le concentrer sur le tissu cible en réduisant la toxicité systémique. En outre, ils résolvent les problèmes de certains médicaments comme la faible solubilité ou l'instabilité chimique. En outre, la pharmacocinétique des médicaments est améliorée et les résistances des médicaments utilisés dans la chimiothérapie sont réduites [5]. En conséquence, les nanotechnologies développées pour le traitement du cancer du sein ont obtenu une plus grande efficacité et survie chez les patients atteints de cancer du sein et une réduction des effets indésirables de la chimiothérapie.
Caractéristiques et mécanismes d’entraînement des nanoparticules
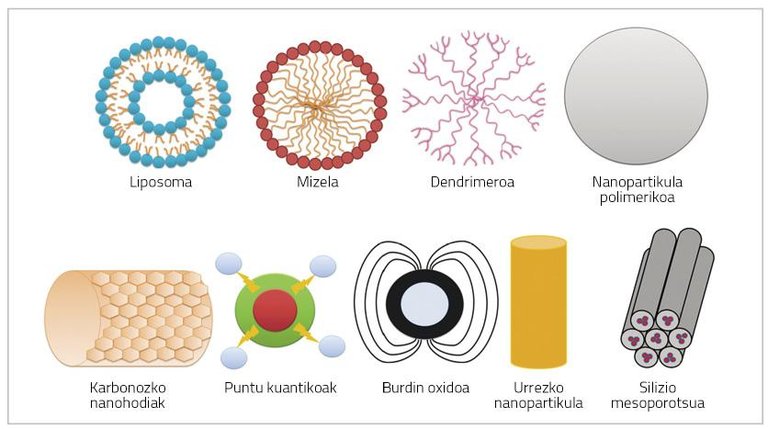
Les nanoparticules sont des particules de très petite taille (100 nm) qui peuvent être constituées de polymères, lipides, virus ou composés organométalliques (Figure 1) [6].
Pour que les médicaments utilisés dans le traitement du cancer du sein soient pleinement efficaces, il est nécessaire de prendre en compte deux facteurs. D'une part, atteindre le tissu dans lequel la tumeur est la plus grande dose possible de médicaments, et d'autre part, que le médicament qui arrive au tissu affecte directement les cellules cancéreuses. Ces deux actions peuvent se produire par routage passif ou actif par nanoparticules (figure 2) [4].
Acheminement passif
Le médicament est administré de manière inactive et, en arrivant au tissu tumoral, il est métabolisé, activé et devient un médicament très toxique [7, 8, 9]. Le routage passif peut être réalisé de trois manières:
a) Augmentation de la perméabilité des vaisseaux sanguins et effet de rétention (EPR)
Comme les cellules tumorales et les tissus tumoraux augmentent, votre besoin en oxygène et en nutriments augmente. Pour répondre à ces besoins en oxygène et en nutriments, un nouveau système de capillaires sanguins est créé qui ne se développe pas complètement et qui est donc plus perméable pour certaines particules de certaine taille. C'est pourquoi les nanoparticules s'accumulent généralement dans les cellules tumorales, ce qui permet d'augmenter la dose de médicament qui influencera l'intérieur des cellules cancéreuses sans provoquer de toxicité dans les cellules saines [4, 8].
b) Microenvironnement tumoral
Cette stratégie considère l'environnement de la tumeur. Le médicament est administré au patient conjugué (inactif) avec une molécule spécifique de la tumeur et, à son arrivée, le contour de la tumeur en fait une substance active [10].
c) Administration in situ
L'application directe du médicament chimiothérapeutique sur la tumeur empêche la toxicité systémique et permet de réduire la dose du médicament. Par exemple, l'administration de C mitomicine - dextrane conjugué à l'intérieur de la tumeur a permis de détecter une plus grande concentration du médicament anticanal dans la zone tumorale et une diminution de la toxicité systémique [8].
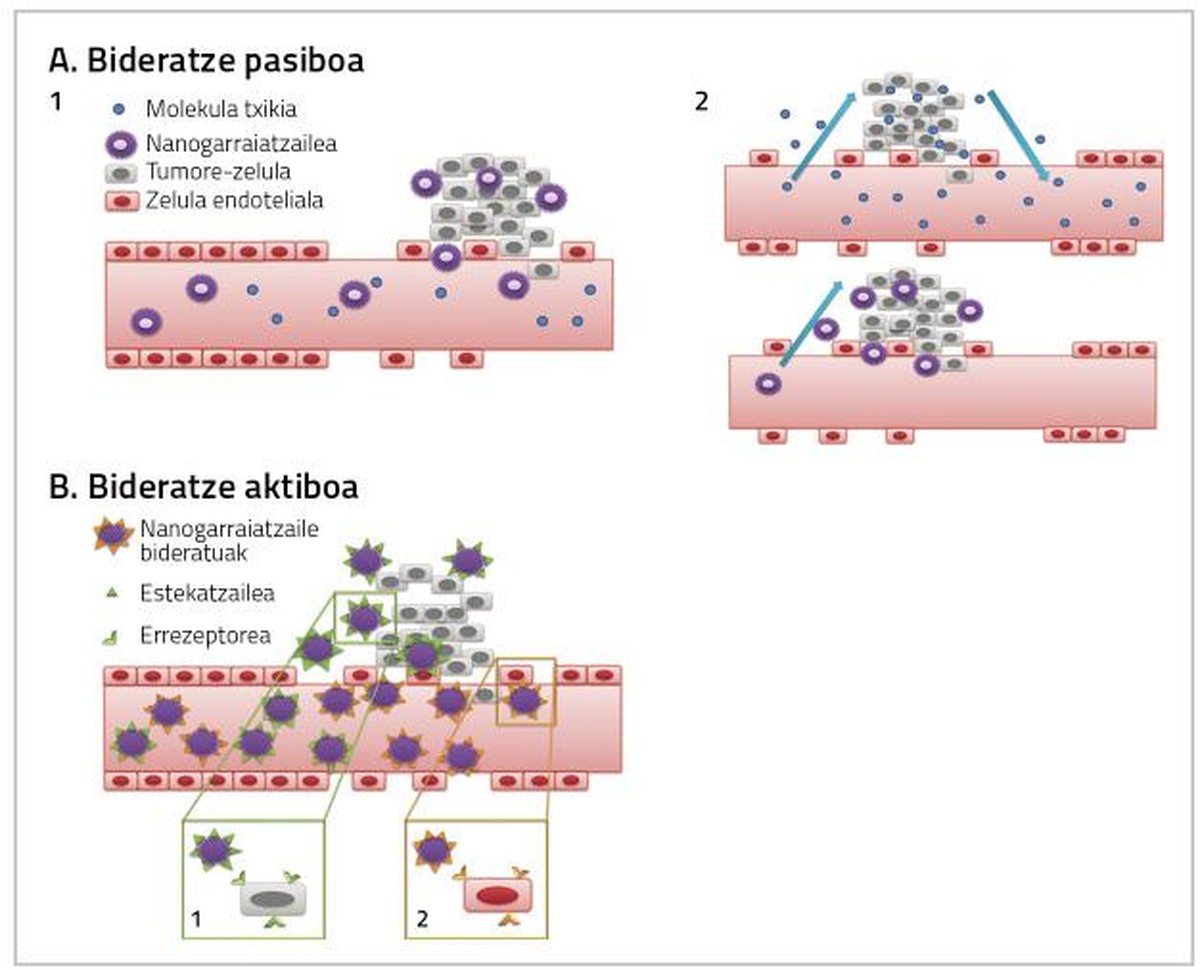
Routage actif
Le but du routage actif est d'interagir avec les nanoparticules conjuguées avec les cibles de la zone objet du traitement, afin que le tissu cancérogène atteigne une plus grande dose de médicament (figure 2).
Les cellules cancéreuses présentent des caractéristiques similaires aux tissus sains. Par conséquent, pour la séparation de ces cellules, des liants spécifiques sont utilisés aux récepteurs qui sont surexprimés dans les cellules cancéreuses, générant des interactions spécifiques. Quelques exemples sont l'association de glucides de lectine, récepteurs de liants et anticorps d'antigènes [8, 9, 11].
a) Orientation aux glucides
L'un des exemples les plus importants est celui de l'hydrate de carbone de lectine. Les glucides trouvés sur la surface des cellules tumorales ne sont pas comme ceux des cellules normales. La lectine est capable de reconnaître les glycoprotéines présentes sur la surface cellulaire et de les associer à elles. Par conséquent, certains glucides interagissent avec des lectines, créant des liens cellulaires spécifiques. Les lectines peuvent donc être des molécules pour transférer le médicament vers les cellules ou tissus auxquels il est adressé. Cette association de glucides de lectine permet de développer deux nanoparticules différentes. D'une part, les lectines peuvent être intégrées dans les nanoparticules et interagissent avec les glucides présents sur la surface des cellules cibles. C'est ce qu'on appelle la conduite directe de lectines. D'autre part, les glucides sont intégrés dans des nanoparticules pour interagir avec les lectines présentes dans les cellules cibles. C'est ce qu'on appelle l'escalade inverse de lectines [4].
b) Conduite des récepteurs
Le médicament est associé à un convoyeur polymère qui se lie aux cellules grâce à un liant qui porte dans la structure [12]. Un exemple est le récepteur de folates. Quand un conjugué destiné aux folates sur la surface cellulaire rejoint les récepteurs de folates, la membrane plasmatique recueille ce conjugué du récepteur et le liant formant un endosome. Le pH endosomique est acidifié et comme les lysozymes sont activés, le médicament est libéré du conjugué et introduit dans le cytoplasme. Pendant ce temps, le récepteur folate libéré retourne à la membrane plasmatique pour redémarrer le processus [4].
d) Traitement des anticorps
Cette stratégie est basée sur l'action d'anticorps monoclonaux pour orienter les nanoparticules vers le tissu tumoral [12]. Les immunolyposomes en sont un exemple. Les liposomes conjugués avec des anticorps forment un lien spécifique avec l'antigène superficiel des cellules cibles, par lequel le médicament anticancéreux atteint le tissu tumoral (Figure 2) [13].
Réflexions finales
Compte tenu de ces possibilités, on peut prévoir l'efficacité de ces nanomédicine. Cependant, peu de nanomédicine sont mis sur le marché et beaucoup de ceux existants pour leur commercialisation sont trouvés dans des essais cliniques ou dans des phases précliniques. Même si cela prend beaucoup de temps et beaucoup de financement, les avantages que peuvent rapporter les nanoparticules rendent nécessaire de tenir compte de leur importance. Il faudra donc entreprendre davantage de recherches et développer de nouvelles nanoparticules, car en plus de faire de grands progrès dans la technologie pharmaceutique et la santé, elles peuvent apporter un énorme bénéfice à la société.
Bibliographie Bibliographie
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian