Martin Karplus «Il est très important de comprendre le fonctionnement des protéines»
Martin Karplus est né à Vienne en 1930. À huit ans, soupçonnant la famille de produire l'occupation allemande, il s'enfuit aux États-Unis. Il a étudié à Harvard College et a obtenu son doctorat à l'Institut de technologie de Californie en 1951 sous la direction du prestigieux Linus Pauling. (Pauling a reçu deux prix Nobel en 1954 en chimie et en 1962 en paix). Il a développé diverses méthodologies de chimie théorique Karplus et mené des recherches dans de nombreux domaines. Il a publié plus de 600 articles dans des revues spécialisées. Il souligne son travail en résonance magnétique. Il est actuellement chercheur dans les universités de Harvard (États-Unis) et de Louis Pasteur (France).
Karplus a donné une conférence à Donostia, avec la Faculté de Chimie de l'UPV et Kutxa. Avant de commencer la conversation, Martin Karplus nous a offert l'occasion de discuter avec lui, attentivement.
En 1938. Nous sommes allés d'Autriche, avant que les nazis soient venus. Mes parents savaient que quelque chose devait arriver, d'autres n'ont pas eu l'occasion, mais nous avons eu de la chance. J'avais huit ans quand nous sommes allés et cinq quand j'ai commencé à étudier l'anglais. Dans la famille, on pensait que ce serait nécessaire et c'était ainsi. Nous sommes allés en Suisse, puis en France et enfin aux États-Unis.
Je ne me souviens pas de tous les détails, il était juste un garçon de huit ans. Mais je me souviens des sensations, des voyages d'un côté à l'autre et des choses comme ça.
Je ne travaillais pas autour de l'ADN, mais avec d'autres systèmes plus petits. Mais Pauling oui, il était là. En 1953, la découverte de la structure de l'ADN fut publiée. Pauling était passionné de lire. Elle a vite réalisé que l'hypothèse de Watson et Crick était correcte et pourquoi elle avait tort. Il proposait une structure contraire (interne externe et interne) et s'appropriait alors sa faute.
Il est vrai qu'en lisant simplement la séquence du génome, nous n'aurons pas de solution aux problèmes génétiques. En outre, nous n'avons pas encore une séquence complète. Cependant, il est important de faire les premiers pas et je pense que cette étape nous a appris une nouvelle façon de travailler. Sans doute, à cet égard surgiront des problèmes éthiques.
J'ai fait quelques expériences, mais ce sont des exceptions. Après avoir quitté le laboratoire de Pauling, je suis allé en Angleterre et j'ai commencé à chercher un cadre adéquat et théoriquement analysable. En fin de compte, je suis allé à l'université de l'Illinois, parce que l'IRM que je faisais des recherches était un nouveau domaine et tout à fait approprié.
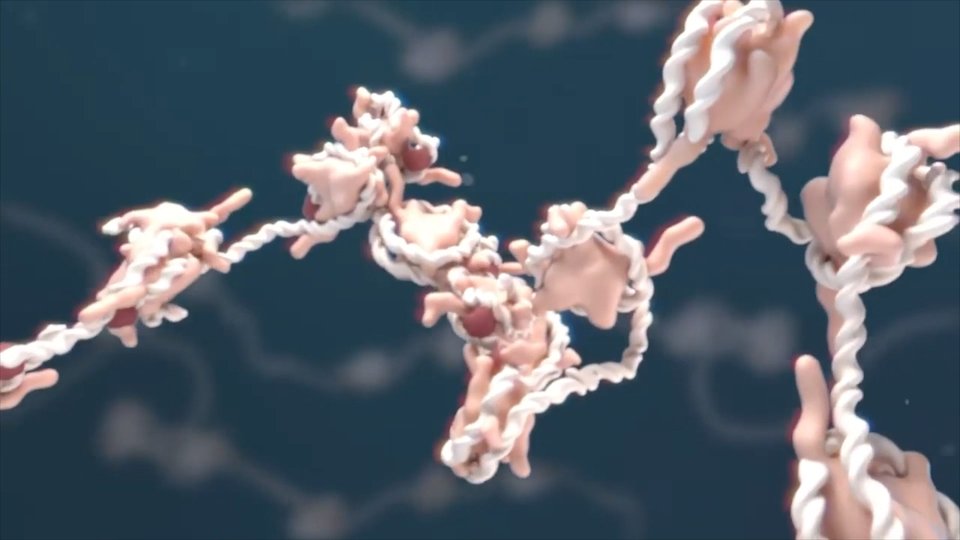
Les protéines sont non-nahi. Vous êtes également fait de protéines. Il est donc très important de comprendre comment ils font ce qu'ils font. Pour cela, il faut bien vérifier le système. Par exemple, lorsque vous jouez au billard, vous devez analyser la direction de la balle et détecter la conséquence de chaque choc. En même temps, les protéines formées d'atomes étant, nous essayons d'analyser l'interaction de chacun avec les autres et de comprendre comment se déplacent les protéines complètes. S'ils étaient des systèmes rigides, ils ne pourraient pas remplir leur fonction, ils ne pourraient pas catalyser les réactions ou effectuer le transport d'oxygène, etc. Par conséquent, les mouvements des atomes sont très importants pour le fonctionnement des protéines. C'est ce que nous modélisons. Mais ce sont des systèmes très grands, avec des milliers d'atomes.
La taille est l'une des difficultés. Il y a vingt-cinq ans, les chimistes voyaient impossible de modéliser les protéines, car la plupart étudiaient des systèmes très petits. Cependant, il est actuellement admis que vous pouvez extraire des informations utiles de ces systèmes.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian