Martin Karplus «Es muy importante comprender el funcionamiento de las proteínas»
Martín Karplus nació en Viena en 1930. A los ocho años, con la sospecha de que la familia iba a producir la ocupación alemana, huyó a Estados Unidos. Estudió en Harvard College y se doctoró en el Instituto de Tecnología de California en 1951 bajo la dirección del prestigioso Linus Pauling. (Pauling recibió dos Premios Nobel en 1954 en Química y en 1962 en Paz). Ha desarrollado diversas metodologías de química teórica Karplus y ha realizado investigaciones en muchos campos. Ha publicado más de 600 artículos en revistas especializadas. Destaca su trabajo en resonancia magnética. Actualmente es investigador en las universidades de Harvard (Estados Unidos) y Louis Pasteur (Francia).
Karplus ha ofrecido una conferencia en Donostia, de la mano de la Facultad de Química de la UPV y Kutxa. Antes de comenzar la charla, Martin Karplus nos ofreció la oportunidad de charlar con él, atentamente.
En 1938. Fuimos de Austria, antes de que vinieran los nazis. Mis padres sabían que debía pasar algo, otros no tuvieron oportunidad, pero nosotros tuvimos suerte. Tenía ocho años cuando fuimos y cinco cuando empecé a estudiar inglés. En la familia se pensaba que sería necesario y así fue. Fuimos a Suiza, luego a Francia y finalmente a Estados Unidos.
No recuerdo todos los detalles, sólo era un niño de ocho años. Pero recuerdo sensaciones, viajes de un lado a otro y cosas así.
Yo no trabajaba en torno al ADN, sino con otros sistemas más pequeños. Pero Pauling sí, en eso estaba. En 1953 se publicó el descubrimiento de la estructura del ADN. Pauling se quedó apasionado al leer. Pronto se dio cuenta de que la hipótesis de Watson y Crick era correcta y por qué ella estaba equivocada. Él proponía una estructura contraria (interna externa e interna) y en ese momento se apropió de su culpa.
Es cierto que con sólo leer la secuencia del genoma no vamos a tener solución a problemas genéticos. Además, todavía no tenemos una secuencia completa. Sin embargo, es importante dar los primeros pasos y creo que este paso nos ha enseñado una nueva forma de trabajar. Sin duda, a este respecto surgirán problemas éticos.
Hice unos pocos experimentos, pero son excepciones. Después de abandonar el laboratorio de Pauling, me fui a Inglaterra y empecé a buscar un marco adecuado y teóricamente analizable. Al final fui a la universidad de Illinois, porque la resonancia magnética que allí estaba investigando era un campo nuevo y totalmente apropiado.
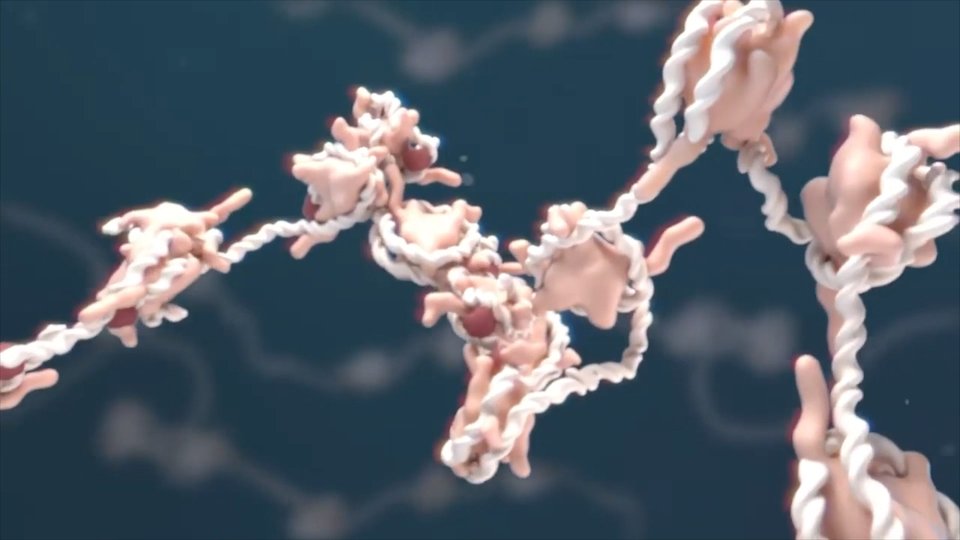
Las proteínas son non-nahi. Tú también estás hecha de proteínas. Por tanto, es muy importante entender cómo hacen lo que hacen. Para ello hay que revisar bien el sistema. Por ejemplo, cuando estás jugando en el billar debes analizar la dirección de la bola y detectar la consecuencia de cada choque. Al mismo tiempo, al estar las proteínas formadas por átomos, tratamos de analizar la interacción de cada uno con los demás y de comprender cómo se mueven las proteínas completas. Si fueran sistemas rígidos, no podrían cumplir su función, no podrían catalizar las reacciones o realizar transporte de oxígeno, etc. Por tanto, los movimientos de los átomos son muy importantes para el funcionamiento de las proteínas. Eso es lo que estamos modelizando. Pero son sistemas muy grandes, con miles de átomos.
El tamaño es una de las dificultades. Hace veinticinco años los químicos veían imposible modelizar las proteínas, ya que la mayoría estudiaba sistemas muy pequeños. Sin embargo, en la actualidad está admitido que se puede extraer información útil de estos sistemas.
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian