Cuando Einstein chocó con la luz

En 1905, Einstein explicó el efecto fotoeléctrico. Para ello tuvo que basarse en la teoría de los cuantos. Para analizar la historia del descubrimiento del cuántico, primero hay que mirar hacia atrás. Es preciso analizar el debate sobre la naturaleza de la luz.
En 1801 el físico inglés Tomás Young quiso comprender mejor lo que es la luz. Hasta entonces, Newton decía que la luz estaba formada por pequeñas partículas. Pero Young hizo pasar la luz por dos rendijas y, al igual que las ondas flotantes, vio que se difractaba. Por lo tanto, dedujo que la luz es la onda. Einstein dio la razón a ambos cuando explicó el efecto fotoeléctrico.
Efecto fotoeléctrico
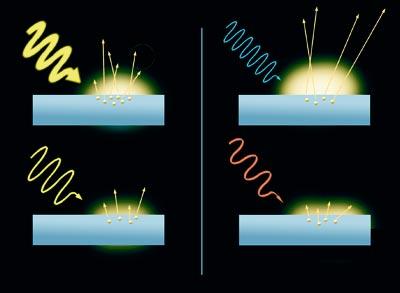
Es un efecto curioso. Cuando los rayos de luz impactan sobre la superficie de un metal, hacen que se extraigan los electrones. Este es el efecto fotoeléctrico. Además, el resultado varía en función del color de los rayos. Los electrones liberados por la luz azul se mueven más rápido que los liberados por la luz roja. De hecho, cuanto mayor es la energía del rayo de luz (la de la luz azul es mayor que la de la roja), más rápido es el movimiento de los electrones. Por otra parte, el número de electrones liberados del metal depende de la intensidad de la luz, a mayor intensidad de la luz, mayor número de electrones. Sin embargo, la luz no libera electrones sin tener una energía mínima.
Partió de la teoría de Einstein Planck. Esta teoría tiene en cuenta que la luz es la onda, que tiene una frecuencia y que la frecuencia es proporcional a la energía.
La ola es un ejemplo sencillo. La frecuencia es el intervalo de tiempo entre una ola y la siguiente; cuanto mayor es el intervalo, menor es la frecuencia. Volviendo a la luz, la luz roja tiene menos frecuencia que el azul, por lo que, según la teoría de Planck, la energía es mucho menor. De hecho, los electrones fuertemente unidos no pueden ser liberados por radiaciones de baja frecuencia. Requieren mucha energía.

Así, en 1905 dio una explicación detallada del efecto fotoeléctrico. Asumiendo que los electrones que se liberan tienen ciertos niveles de energía, como Planck, el joven Albert Einstein propuso que con la radiación ocurre lo mismo. Einstein se dio cuenta de que ambas energías están unidas en el efecto fotoeléctrico, por lo que el choque debe interpretarse como un choque entre dos partículas, es decir, que la luz actúa como una bola de billar. Llamó fotón a la partícula de luz y reclamó que la energía del fotón es proporcional a la frecuencia de la luz, como en el caso de la onda. Por tanto, según la hipótesis de Einstein, la luz es a la vez partículas y ondas.
Esta es la explicación por la que Einstein fue galardonada con el Premio Nobel de Física de 1921 y no por la teoría de la relatividad, aunque, sin duda, aquella teoría y el resto de sus aportaciones a la física fueron importantes. Probablemente ganen el premio Nobel.

El trabajo ganador del Premio Nobel de Física se titula: Über einen die Erzeugung und Verwandlung des Lichts betreffen heuristischen Gesichtspunkt (Desde una perspectiva heurística, sobre la producción y transformación de la luz). Además de dar una explicación del efecto fotoeléctrico, es una obra básica para la física cuántica, muy revolucionaria, según el autor.
Sin embargo, aunque Einstein tuvo una gran importancia en los inicios de la teoría cuántica, la verdadera revolución de la cuántica fue XX. Comenzó en el segundo cuarto del siglo y Einstein no lo hizo.
Einstein dijo que la luz no sólo puede actuar como onda, sino como partícula, mientras que Louis de Broglie afirmó que las partículas también pueden actuar como ondas. Pero, ¿qué significaba eso? Que cualquier materia tiene naturaleza ondulatoria. Eso sí, puedes jugar como ondas tus sillas, perros, árboles o tú mismo. Lógicamente, cuando se trata de cuerpos muy grandes, la naturaleza ondulatoria no tiene fuerza, por lo que este efecto no se nota en la materia que vemos, pero sí a nivel atómico y menor. Es decir, si un haz de electrones se hace pasar por una pared con dos ranuras, como las olas del mar (y no como las bolas del billar) interferirán entre sí, es decir, se comportarán en forma de ondas. Prueba de ello son algunas de las técnicas más extendidas en la actualidad como el microscopio electrónico.

vez partículas y ondas.
A partir de ese momento no podemos distribuir el concepto de partícula y onda. No. Se puede decir que son dos perspectivas del mismo concepto. En algunos casos la materia aparece en forma de partículas o corpúsculos y en otros en forma de ondas. Pasaron años hasta que los físicos aceptaron esas conclusiones.
Este trabajo fue la base de la nueva rama de la física desarrollada gracias a la teoría del cuanto: la física cuántica. La aportación de Einstein se toma como el verdadero punto de partida de la física cuántica, ya que Planck sólo aportó el concepto de cuanto. Posteriormente, a partir del trabajo de Planck y Einstein, otros muchos físicos dieron una interpretación sorprendente a la física cuántica.
Saltar a los átomos
Entre los que dieron un nuevo rumbo a la teoría del cuántico, destaca Niels Bohr. El físico danés aplicó a los átomos la teoría que se aplicaba a la radiación. Es decir, cultivó el modelo atómico. En su opinión, los electrones de los átomos no podían tener cualquier energía. Alrededor del núcleo se movían en varias manchas, cada una de ellas con un nivel de energía determinado. Cuanto más cerca esté el electrón del núcleo, más energía es necesaria para evacuarlo.
El modelo atómico de Bohr es planetario, es decir, los electrones giran en órbita alrededor del núcleo. Según Bohr, las órbitas electrónicas son estables y se producen en determinados niveles energéticos, es decir, sus energías están cuantificadas.

Por ejemplo, cuando el hidrógeno se calienta en un recipiente cerrado y transparente, emite luz que se llama espectro de emisión de hidrógeno. El modelo de Bohr explica muy bien por qué la luz emitida es de ciertos colores o frecuencias, y no blanca (si se emitieran todos los colores de luz sería blanca). Todo ello está relacionado con los niveles de energía discreta o cuantizada de los electrones.
Sin embargo, el modelo de Bohr sólo puede explicar el espectro del hidrógeno. Aunque adecuado para el átomo de hidrógeno, no era capaz de explicar el espectro atómico de los sistemas compuestos por dos electrones. De hecho, el modelo de Bohr sólo mostraba átomos de un solo electrón. Y, sin embargo, ¡no es poco, no te lo pienses! Por el contrario, gracias a Bohr se abrieron las puertas y el resto de físicos pudieron analizar átomos más complicados.
La revolución cuántica tardó 15 años más en aparecer los espectros atómicos de los elementos multi-electrón. Esto supuso, además, la desaparición del modelo atómico planetario.
En 1926, Schrödinger publica la célebre ecuación que lleva su nombre. El modelo atómico planetario se superó, pues esta ecuación pone de manifiesto que los electrones se comportan en forma de onda en los átomos. Por ello, no se puede hablar de órbitas de electrones, ya que una onda no se encuentra en un lugar físico determinado, sino en un área más amplia. Y a esto no se le llama órbita, sino orbital. Es decir, el orbital nos da la probabilidad de encontrar electrones en un lugar. Por tanto, en lugar de hablar de las órbitas de los electrones, hay que hablar de la probabilidad de encontrar electrones.
Sin duda alguna, todas estas teorías son fruto de los trabajos realizados por Planck y Einstein. La física teórica dio grandes pasos, pero no quedó en una mera teoría. Tuvo muchas aplicaciones. Estas apps sorprenderían también a Einstein.
Fisión, hija de la relatividad
Huella en las novelasEn la actualidad parece que los Premios Nobel de Física están más distribuidos, por decirlo de alguna manera. De hecho, en los últimos años se han premiado obras de diferentes áreas de la física, como las de superconductores, neutrinos cósmicos, condensados Bose-Einstein, etc. Todos son temas muy diferentes. Antiguamente, con el paso del año, los temas relacionados con el efecto fotoeléctrico o la naturaleza del átomo fueron los que más premios recibieron. Todo comenzó en 1918 con Planck. En 1921 Einstein recibió el Premio Nobel de Física por la explicación del efecto fotoeléctrico. Sin embargo, el efecto fotoeléctrico y la física cuántica no quedaron intactas. Los físicos siguieron trabajando y con buenos resultados. Al año siguiente, en 1922, Bohr recibió el Premio Nobel de Física. Einstein aplicó la teoría aplicada a la luz a los átomos, es decir, propuso el modelo atómico. En 1923, Millikan recibió, entre otras cosas, el premio por confirmar las dos teorías anteriores. En 1925 fue recogido por Franck y Hertz por estudiar los choques entre los electrones y los átomos. Fue donada a Broglie en 1929 por descubrir la naturaleza ondulatoria de los electrones. Según esto, además de la luz, cualquier materia puede actuar como onda. En 1932, por la vía de la mecánica cuántica, también fue premiado Heisenberg. En 1933, Schrödinger y Dirac fueron premiados por desarrollar el modelo atómico planteado por Bohr. El primero, por ejemplo, escribió la ecuación matemática que daba forma de onda o información de cualquier partícula. Como se puede observar, la huella del efecto fotoeléctrico en los premios Nobel de Física no es pequeña. Es significativo. Durante varios años han sido premiados trabajos relacionados directa o indirectamente con este tema. |
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian








