Autonomía fugaz

¿Cuál es el problema? ¿Por qué no hay batería muy resistente? Hay dos posibles respuestas. El primero es que sí, las baterías que utilizamos actualmente son muy duraderas, pero que tiene la misma duración, que el usuario siempre va a pedir más. La batería perfecta no debería cargar. Mientras no se cumpla, el usuario solicitará mejoras.
Otra respuesta es que una batería tiene muchas características --es una duración- y, desgraciadamente, para mejorar una característica debemos renunciar a otra. La batería actual proporciona sin interrupción la energía necesaria. Pequeño. Barato. Y no es muy peligroso.
Por ello, para mejorar el diseño de una batería es necesario decidir cuál de estas características se quiere mejorar a costa de cuál. Nuestro punto de partida es la sostenibilidad. Pues bien, lo primero que hay que sacrificar para hacer una batería muy duradera, es decir, una batería que no necesita recargar durante un mes, sería el tamaño de la batería.
En definitiva, las pilas y las baterías son un conjunto de productos químicos que generan corriente eléctrica. Seleccionando los productos adecuados, los átomos de un producto suministran electrones a los átomos de otro producto. De hecho. Por tanto, para que la batería pueda operar durante más tiempo es necesario aumentar las cantidades de ambos productos químicos. En definitiva, para que el intercambio de electrones se prolongue es necesario introducir muchos electrones en el sistema, lo que significa que se necesitan grandes cantidades de producto donante y receptor. Pero esto genera un problema de tamaño: para aumentar la duración de una batería es necesario aumentar el tamaño. Contrario a lo que exige el mercado.
Pequeños

Los teléfonos móviles actuales son gracias a las baterías. Utilizan baterías muy pequeñas. Y sin embargo, el mercado exige que sean aún más pequeños. En este sentido, los mercados de ordenadores portátiles y teléfonos móviles son muy diferentes. Los ordenadores no tienen una sola batería, sino un grupo de baterías. En los móviles, por el contrario, la batería es única y su tamaño es más importante.
Una forma de fabricar baterías pequeñas es sustituir estos productos químicos. Parece una idea sencilla: sustituir los átomos que ocupan poco espacio por los que ocupan mucho espacio. Para ello es necesario encontrar los átomos pequeños adecuados.
Esta revolución se produjo hace unos veinte años. Hasta entonces predominaban las baterías de níquel y cadmio o níquel y metal hidruro. Se inventó un sustituto de estos sistemas, una nueva tecnología. El cambio más importante era el tamaño del electrolito; las baterías basadas en el níquel utilizaban el hidróxido potásico como fuente de iones, mientras que en las nuevas baterías se empezó a utilizar un pequeño átomo: el litio. Al ser pequeños, los iones de litio dan mucho más poder a la batería.
El litio predomina
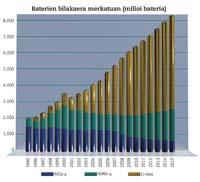
La revolución ha sido muy grande. Las primeras baterías de ion litio fueron lanzadas en 1991 y en la actualidad han colonizado el ámbito de los dispositivos electrónicos convencionales. Prueba la batería del teléfono móvil, GPS, PDA, ordenador, cámara de fotos, etc. Casi todos los dispositivos electrónicos convencionales tienen una batería de ion litio.
La química basada en el litio presenta importantes ventajas frente a la basada en el sistema niquel-cadmio. Por un lado, para el mismo tamaño, la batería de ion litio proporciona mayores potenciales y densidades de energía que la otra. Por otra parte, no tiene efectos de memoria, es decir, aunque se cargue sin descarga completa, la batería no pierde capacidad (para que las baterías de níquel cadmio funcionen correctamente es necesario descargarlas totalmente y cargarlas completamente en cada ciclo, pero no de ion litio). Además, las baterías de ion litio pierden muy poca carga mientras no se usan, a diferencia de las de níquel cadmio.

Aparentemente todo son ventajas, por lo que en las baterías pequeñas actuales, que requieren aparatos eléctricos portátiles, predomina la tecnología del litio. Pero no siempre ha sido así. En los artículos hasta hace tres años, tras explicar las ventajas del litio, se hacía hincapié en una pregunta: "Entonces, ¿por qué no vemos estas baterías en todos los dispositivos?" El problema era la seguridad.
Los químicos saben que el litio es un metal peligroso. Muy reactivo. Se inflama solo en contacto con el aire. El almacenamiento en nitrógeno no es una buena idea, apenas hay elementos que reaccionen con el gas nitrógeno, pero el litio reacciona.
El cátodo de la mayoría de las baterías está formado por un óxido de cobalto. Es un material apropiado pero se degrada por encima de los 160C, desprende oxígeno que reacciona muy rápidamente con el litio y se inflama. Además, la batería contiene disolventes orgánicos inflamables. Esta mezcla es una pequeña bomba. No es una broma: han sido explosiones.
Entre los años 2003 y 2006 se registran los mayores problemas con las baterías de litio en el mercado. Allí, los teléfonos móviles, los ordenadores portátiles, etc. se incendiaron, después de un incendio o explosión de baterías.
Por explosiones o riesgo de explosión, HP, Dell, Toshiba, Sony, Sanyo, Nokia, LG y otros fabricantes tuvieron que sacar del mercado miles de herramientas. Por ejemplo, se escuchaba periódicamente "Toshiba ha pedido a los 340.000 usuarios que han adquirido ordenadores portátiles con batería de este tipo de modelo que devuelvan sus herramientas".
Tiempo de seguridad

La situación actual no es la misma. En los dos últimos años se ha investigado mucho para garantizar la seguridad de las baterías. Por lo tanto, la cuestión de las explosiones está superada y el ion litio ha colonizado el mercado de la batería. ¿Cómo? Pues sobre todo gracias a unos circuitos eléctricos.
Las baterías se calentaban principalmente en los procesos de carga y descarga. Los fabricantes se dieron cuenta de que era un problema eléctrico. Y la solución también podía ser eléctrica. Se añadió un circuito de seguridad, en definitiva un interruptor. Si la temperatura aumenta por encima de 90C o la diferencia de potencial por encima de 4,3 voltios, el circuito interrumpe el flujo de electricidad.
Este problema ha sido solucionado por el circuito y sin embargo este estudio no ha concluido. En los últimos tiempos, el problema también ha sido analizado desde el punto de vista químico: se puede sustituir el óxido de cobalto. Han buscado un material que necesita mucho más de 160 C para degradarse. Con algunos compuestos de manganeso, la distancia de seguridad aumenta en 20 C. Y con algunos fosfatos, 50 C más que con el óxido de cobalto. Como contrapartida, se pierde la densidad energética, ya que los cátodos de óxido de cobalto son los que acumulan mayor densidad energética.
Por el momento, el óxido de cobalto predomina en los cátodos de las baterías de ion de litio que usamos, pero en breve los nuevos materiales podrían sustituir el cobalto. El fosfato, por ejemplo, fue probado por primera vez en 1997 y ya se han empezado a comercializar baterías fosfatadas. Las baterías son más seguras y además el fosfato es más barato que el óxido de cobalto.
Último, polímeros
La investigación de materiales también ha incidido en un ámbito diferente al de la seguridad: el tamaño. El litio es pequeño y es difícil encontrar un electrolito más pequeño, pero existe la posibilidad de reducir la zona en la que se mueve este electrolito. En lugar de sumergirse en un líquido orgánico en un sólido filamentoso, se pueden hacer baterías más finas. Con esta idea nacen las baterías de ion litio con soporte polímero, las baterías de polímero de litio.

¿Qué se pierde en este caso? Como es lógico, al utilizar un sólido en lugar de un líquido se pierde la movilidad del electrolito. El polímero no es un sólido rígido sino un gel, y sin embargo es el problema de la movilidad. En consecuencia, la batería no aporta tanta tensión como la del ion de litio convencional. En lugar de 3,7 voltios, el polímero de litio queda alrededor de 3,4.
No supone una gran reducción, pero hay que tener en cuenta que esta tecnología debe responder a la danza del mercado. A medida que avanza la investigación de las baterías, el mercado también ha evolucionado. En el caso de los ordenadores portátiles, las baterías no han cambiado tanto porque han avanzado con un estándar. Por el contrario, los teléfonos móviles, además de ser cada vez más pequeños, ofrecen cada vez más recursos: Capacidad de conexión a Internet, ampliación y mejora de pantallas, etc.
El mercado demanda baterías más potentes, no sólo más sostenibles y pequeñas. Y para satisfacer esta necesidad, espera la próxima revolución de las baterías.


Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian