Stratégies de virus pour l'invasion cellulaire
1996/01/01 Nieva, Jose Luis Iturria: Elhuyar aldizkaria
Les virus se situent généralement à la limite entre vivants et inertes. Les virions ne possèdent pas de machine métabolique propre, qui est, ne sont pas en mesure de construire par eux-mêmes leurs composants structurels à partir de antécédents métaboliques. Pour pouvoir se reproduire, il est donc nécessaire d'envahir d'autres êtres (hôtes) et de s'approprier la machine métabolique des cellules.
Dans l'information génétique que portent les virus protégés à l'intérieur, les commandes sont accumulées pour inhiber le métabolisme de la cellule infectée et orienter la synthèse des composants du virus. Par conséquent, les virus sont des parasites moléculaires qui peuvent parfois devenir des prédateurs et conduire à la mort sans pitié en étant infecté.
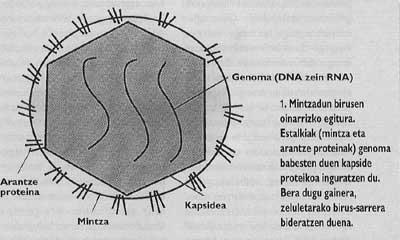
Par conséquent, pour reproduire, les virus sont indispensables pour que votre génome (ADN ou ARN) entre à l'intérieur de l'hôte. Le processus à suivre est appelé introduction. Étant donné que l'entrée est obligatoire pour la lnection, cela a une grande importance dans le cycle de vie des virus. Dans le cas de virus qui pénètrent dans les cellules eucariotes, les virions doivent surmonter la couverture moléculaire externe ou membrane entourant la cellule.
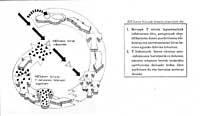
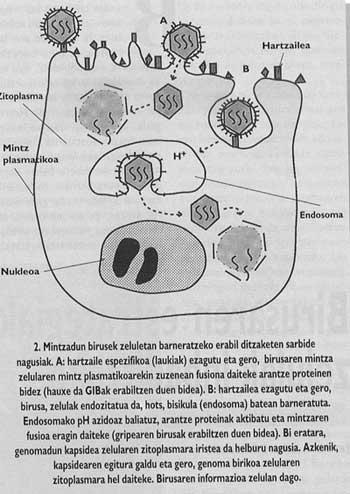
De même, les animaux et les virus les plus importants capables d'infecter l'homme sont entourés d'une membrane comme celle des cellules dites couvertes (Figure 1). Afin d'orienter l'entrée, ces virus ont développé des mécanismes d'intégration avec les couvertures des cellules qui envahiront leurs propres couvertures. Une fois la fusion des membranes de la cellule cible et du virion obtenue, le génome du virus peut atteindre le cytoplasme de la cellule (Figure 2) d'où commencer à reproduire.
Les stratégies d'entrée développées par les virus cachés sont des processus très complexes qui, pour bien les comprendre, les scientifiques font des efforts constants, car si nous pouvions apprendre comment éviter l'entrée de l'ennemi tué, nous serions en voie de protection pour certaines infections. Afin de trouver un moyen simple et global d'inhiber les infections virales, les chercheurs ont cherché les éléments communs de l'entrée.
Malheureusement, les choses ne sont pas aussi simples que nous le voulons. Comme nous le savons jusqu'à présent, au moins chaque famille de virus a développé une stratégie d'entrée différente, de sorte que l'hypothèse qu'il existe un mécanisme d'entrée générale et commune a perdu de force. En outre, les recherches sur les mécanismes d'entrée de virus n'ont pas encore donné beaucoup de résultats, car au début des années 80, quand les scientifiques ont réalisé qu'il n'était pas possible de produire un vaccin universel contre le virus qui produit la grippe, ce champ a commencé à se développer et peut être considéré comme nouvellement créé.
Selon le chercheur espagnol Rafael Blasco: "La recherche sur tout virus est morte au moment où le vaccin est développé pour traiter la maladie qu'il provoque". M. Blasco est le spécialiste le plus important de l'État dans l'introduction de virus comme le Poxvirus qui crée la variole. Le virus de la Navarre est le premier être que les êtres humains ont volontairement fait disparaître de la planète, donc Blasco dit qu'il n'y a pas trop de responsabilité sur l'entrée de leurs familles qui sont considérées comme peu importantes.
L'erreur de cette approche a été mise en évidence ces derniers temps, sans savoir comment arrêter les parasites de la grippe et du sida. Aujourd'hui, il n'est pas possible de prédire le type de virus qui provoquera l'épidémie suivante. Pour surmonter cette incapacité, il serait important de développer une thérapie universelle pour traiter toute infection virale. Pour cela, il est également nécessaire d'étudier en profondeur les processus d'entrée de virus. Le virus de la grippe, par exemple, est spécialiste en truffes avec notre protection immunitaire. Pour neutraliser également les virus et autres agents étrangers, les défenses du corps humain doivent connaître et différencier au préalable ces agents étrangers. Ceci est actuellement obtenu par des vaccins. Les vaccins révèlent l'identité des agents étrangers aux défenses du corps, de sorte que les cellules qui produiront des anticorps qui doivent être attachés à ces agents soient prêtes avant l'infection.
Dans le cas de la grippe, cependant, les choses ne sont pas si faciles. Les vaccins antigrippaux doivent être modifiés chaque année, car chaque scorie du virus de la grippe présente des antigènes différents (c'est-à-dire différents groupes de molécules virales qui peuvent identifier les anticorps). De plus, il semble que le virus lui-même va changer dans les générations suivantes, sachant qu'il met intentionnellement en évidence ces molécules. De cette façon, nous pouvons produire facilement des anticorps contre le virus, mais seul le virus lui-même connaîtra ces molécules « malicieusement exposées ».
En d'autres termes, la protection offerte par les vaccins obtenus par l'utilisation de virus anciens ou d'une scorie particulière n'a aucune valeur contre de nouveaux virus ou d'autres scories. Et naturellement, la nature ou "identité" du virus peut être changée presque annuellement. En revanche, il est évident que les virus ne font rien de propre. En raison de leur taux élevé de réplication, les processus sélectifs influencent généralement fortement les virus et leur évolution est généralement esclave. Dans ce processus évolutif, les types de virus favorisés sont les plus variables, car ils ont généralement une plus grande facilité pour surmonter les systèmes immunitaires.
Ainsi, les chercheurs du Centre mondial de la grippe, situé chaque année à Atlanta, tentent de découvrir avec enthousiasme l'identité du responsable de la prochaine épidémie de grippe. Deux ou trois mois avant l'arrivée de l'hiver, le virus doit être identifié, purifié et préparé en grandes quantités. Sinon, une partie importante de la population composée de personnes âgées, de malades chroniques et d'autres immunodéprimés serait en danger (indirectement, la grippe provoque plus de décès annuels que le sida). Dans le cas de la grippe, l'importance de trouver une alternative thérapeutique différente au vaccin est évidente.
Mais l'exemple le plus connu du manque de succès des vaccins est le vaccin contre l'agent viral du SIDA, qui jouit aujourd'hui d'une réputation malheureuse. Ce virus, appelé VIH (Virus de l'immunodéficience humaine), est un virus de type retrovirus qui dans son cycle de vie donne un long espace intégré dans les cellules des clients. Ainsi, après être entré dans l'hôte, l'information génétique du virus peut se cacher entre l'information génétique de la cellule et rester en état latent pendant plusieurs années (on estime que cette situation peut durer plusieurs années).
La principale défense contre ce type de virus est la détection et la destruction de cellules infectées, à savoir le processus appelé immunité cellulaire. À plusieurs reprises, les cellules envahies présentent dans leur peau des fragments d'agent étranger qui, pour ainsi dire, indiquent leur état. Dans ces cas, les cellules spécialisées avec fonction de lavage détectent ces « symboles » et détruisent les cellules infectées. Les cellules nettoyantes sont des cellules T cytotoxiques. Dans des situations infectieuses, ces cellules ont besoin d'autres cellules intermédiaires qui permettent leur croissance.
Ces cellules, qui remplissent la fonction d'intermédiaires spécialisés, sont des lymphocytes cédant, plus précisément des lymphocytes de type T4. En outre, ces lymphocytes sont indispensables pour coordonner d'autres homicides immunitaires. Malheureusement, les lymphocytes T4 sont des proies préférées du virus du VIH et ce système défensif non parfait peut devenir plus défectueux si l'infection par le VIH provoque la disparition des lymphocytes T4 qui agissent comme intermédiaires. Ainsi, en arrivant à l'effondrement du système, une immunodéficience se produit qui rend l'organisme non protégé contre toute infection et peut arriver à la mort.
Ce type d'infection entrave le développement du vaccin. D'une part, le vaccin serait un remède peu efficace pour les personnes infectées, car les anticorps ne pourront détecter que des virus assemblés externes au travail cellulaire (c'est-à-dire avec couverture), car le virus VIH en latence est indétectable pour nos défenses. D'autre part, les vaccins les plus efficaces jusqu'ici ont été préparés avec des virus plus faibles, à savoir des vaccins qui peuvent causer des infections à petite échelle. Évidemment, une personne en bonne santé ne peut pas administrer ce type de vaccin contre le VIH, car le risque d'infection irréversible et mortelle est excessif.
Pour surmonter cette barrière, on étudie actuellement des vaccins synthétiques et recombinants. Bien que les deux modèles de vaccins soient en phase d'essai, pour être efficaces à l'avenir, ils devront surmonter un grand obstacle : comme dans le cas de la grippe, les caractéristiques immunogéniques les plus importantes du VIH sont à la fois les plus changeantes, dont elles semblent démontrées intentionnellement le virus lui-même. Si nous pouvions différencier les parties immunogéniques inaltérables, nous aurions plus de chances de préparer un vaccin efficace. Pour cela et comme nous le verrons plus loin, il est nécessaire d'étudier en profondeur la biologie du virus. Dans un proche avenir, le vaccin contre le VIH semble un rêve. C'est ce qu'ont confirmé les experts qui se sont approchés du Congrès mondial sur le sida qui s'est tenu à Osaka début août 1994.
Le problème des pandémies de grippe et de sida nous pousse à étudier la biologie des virus qui provoquent ces maladies. Les deux sont des virus à couverture, c'est-à-dire entourés d'une membrane lipidique comme les membranes cellulaires (figure 1). En fait, les virions volent la membrane de la cellule qu'ils sont nés. Cependant, les membranes des virus ne contiennent pas les mêmes protéines que la membrane cellulaire, mais les glycoprotéines virales spéciales appelées protéines épineuses. Dans ces protéines spécifiques pourrait être le cou de la lutte contre les virus comme la grippe et le VIH.
Dans les mots de judith White, le plus grand spécialiste du monde dans l'introduction du virus de la grippe: « Les protéines d'épines sont des machines essentielles à l'entrée, puisque ces protéines polyvalentes sont celles qui trompent le système immunitaire, connaissent le récepteur cellulaire qui limite le tropisme cellulaire (quel type de cellule va être envahi) et sont supérieures pour remplir les fonctions de fusion de la membrane cellulaire et virale ». Comme vous le verrez ci-dessous, ces protéines sont essentielles dans ce processus, car le blocage de l'une de ces fonctions pourrait compromettre la capacité de pénétration cellulaire des virions.
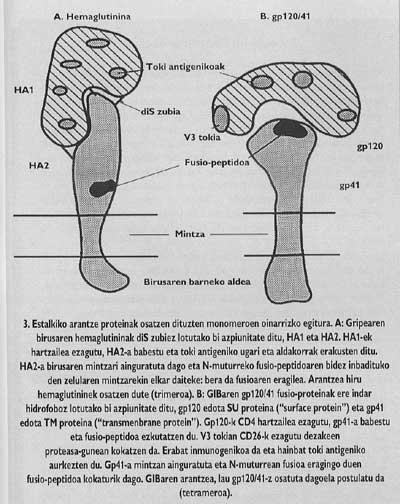
Essayer de freiner l'entrée peut être une bonne méthode dans la lutte contre l'infection virale. Pour cela, nous avons besoin d'une bonne connaissance de la fonction et la structure des protéines épineuses. Une fois connues les parties fonctionnelles de ces protéines et clarifiées les facteurs nécessaires à leur inclusion dans l'hôte, nous pouvons commencer à concevoir des voies qui permettent l'interruption de l'entrée. Les protéines épineuses de couverture du VIH et les virus de grippe sont paradigmatiques à cet égard. Sa structure et ses fonctions sont les plus étudiées (Figures 3-5).
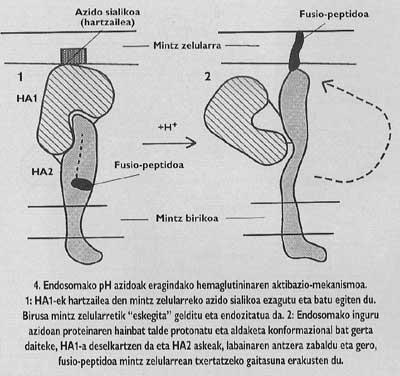
Ces protéines membranaires ont une structure oligomique, c'est à dire, ils sont formés par différents modules. La protéine épine du virus de la grippe, l'hémagglutinine, est hétérotrimère, c'est-à-dire, est construite avec trois monomères formés par deux sous-unités différentes, HA1 et HA2. La sous-unité de la chapelle est ha1 et la sous-unité avec peptide de fusion est ha2. Ce dernier est celui qui, en s'activant avec le pH acide de l'endosome, fait apparaître le peptide de fusion et s'intègre dans la membrane de la cellule cible.
La protéine d'aubépine du VIH est tétrame, c'est-à-dire composée de quatre monomères appelés gp120/41. Dans ce virus, l'activation de la sous-unité avec peptide de fusion (appelé gp/41) est totalement différente du virus de la grippe. Pour que l'activation se produise, il faut libérer cette sous-unité de la sous-unité appelée gp120 qui se trouve dans le chapeau, suivant un mécanisme qui jusqu'à l'année dernière n'était pas tout à fait clair, le Gp41 est relâché en deux étapes. Le premier récepteur CD4 du lymphocyte gp120 est connu et intégré. La connaissance du CD4 est indispensable pour initier le processus de fusion entre membranes, mais n'active pas la sous-unité fusogénique. Les lkerlaris ont constaté que GlBa n'infecte pas les cellules de rats avec un récepteur CD4 semblable à celui humain généré par une ingénierie génétique, bien que ces cellules mutantes aient démontré leur capacité d'adhésion au virus équivalent au lymphocyte T4.
C'est-à-dire, bien que ce récepteur CD4 de cellules rats mutantes fonctionnait comme chez l'être humain (il était capable de se joindre au virus), son adhésion au récepteur n'était pas suffisante pour canaliser la fusion. Ainsi, en plus du récepteur CD4, un autre facteur mystérieux devait influencer les membranes des lymphocytes T4 humains pour rendre ces cellules sensibles au VIH. Par conséquent, il a été proposé que le VIH devrait avoir un second récepteur spécifique. À l'automne 1993, l'équipe d'Ara Hovanessia de l'Institut Pasteur a découvert qu'elle avait identifié ce destinataire.
On savait autrefois que les anticorps monophoniques créés contre le site antigénique V3 (Figure 3) à la surface du Gp120 pouvaient arrêter l'infection. Le succès potentiel des vaccins synthétiques basés sur le GP120 actuellement en cours dépendrait de la protection qui pourrait offrir des anticorps capables de connaître cet endroit. Dans cet endroit il y a une séquence permanente d'acides aminés, c'est-à-dire une séquence d'acides aminés qui ne change pas de génération en génération. Pourquoi cet endroit est-il spécial ? Cette séquence permanente est la séquence "consensus". Les protéases sont des enzymes qui divisent les protéines. Cependant, les enzymes ne coupent pas partout la chaîne protéique, mais par les endroits où il y a certaines séquences d'acides aminés. Ces séquences sont appelées consensus.
Chaque type de protéase ne connaît qu'une séquence de « consensus ». La séquence dans V3 ne peut connaître que des protéines spéciales de l'être humain et l'une d'elles est la molécule réceptrice appelée CD26 qui se trouve à la surface du lymphocyte T4. L'équipe de l'Institut Pasteur a montré que pour entrer dans l'auberge, le VIH a besoin de l'activité protéasique du CD26. À défaut, il n'y a pas d'infection. De plus, les anticorps monofuntionnels fabriqués contre le CD26 (qui ne peuvent être fusionnés qu'avec le CD26) pouvaient empêcher l'entrée du VIH dans n'importe quel type de cellule. De plus, si les cellules qui ne contiennent normalement ni CD4 ni CD26 provoquent la production de ces molécules, les scientifiques de ce groupe ont revendiqué que tout type de cellule était sensible à l'infection par le VIH.
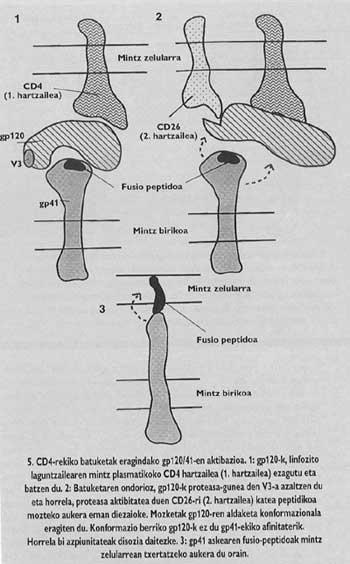
Ce serait donc le facteur mystérieux que nous avons mentionné. Selon cette constatation, lors de la deuxième étape du mécanisme d'activation du GP41 actuellement proposé, le CD26 couperait la chaîne protéique au lieu V3 du GP120 qui était lié à la CD4. La coupe entraînerait un changement dans le formage de GP120, ce qui entraînerait une diminution de l'affinité avec GP41. La perte d'affinité provoquerait la libération du gp41 autour de la membrane de la cellule cible. Ainsi, l'insertion correcte du peptide de fusion est assurée.
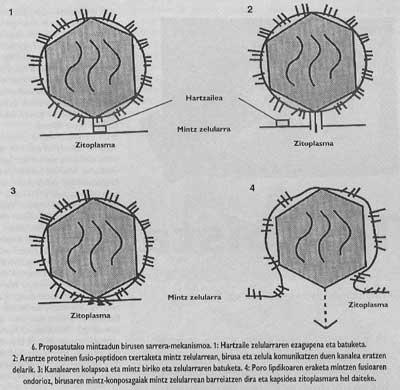
Le schéma général de l'entrée reste inachevé. Bien que nous sachions que la liaison au récepteur et l'introduction de peptides de fusion sont des étapes nécessaires, nous ne savons toujours pas comment la fusion entre le virus et les membranes de la cellule cible est effectuée. Cependant, les données expérimentales que nous avons en ce moment nous indiquent que le mécanisme inspécifique (Figure 6) serait le suivant : une fois insérés les peptides de fusion, le virus de l'épine qui a produit la fusion forme un canal qui peut communiquer la cellule (cette étape peut dire qu'elle a une grande base expérimentale) et ensuite, grâce à un mécanisme encore non clair, le canalon souffre d'un effondrement et, enfin, la membrane du virus. Une fois le pore ouvert, la cellule du virus peut arriver au cytomopien de cellules.
Nous ne savons toujours pas dans quelle mesure ces processus généraux nous seront utiles pour inhiber l'entrée de virus, mais nous pouvons travailler sur des voies possibles pour mener à bien cette hypothétique inhibition. De même, au fur et à mesure que les détails des mécanismes de base du processus seront clarifiés, la possibilité de trouver des solutions augmentera. En fait, essayer d'inhiber le processus d'entrée décrit n'est pas une simple occurrence, mais une réalité qui est déjà mise en œuvre aujourd'hui. Afin de ralentir l'infection à VIH, les fractions solubles du récepteur CD4 sont déjà utilisées comme base de thérapie.
Les chercheurs croient que les virions se joindront à ces fractions et seront inactivés. Comme mentionné précédemment, plusieurs vaccins synthétiques basés sur le GP120 tentent d'attendre que les anticorps contre les lieux immunologiques de ce peptide puissent freiner l'infection au VIH. Des études in vitro ont montré que les peptides de fusion obtenus par synthèse chimique peuvent empêcher l'entrée du VIH. On ne sait pas encore quelle peut être la cause de cette inhibition, mais il est possible que ces peptides libres provoquent des distorsions dans la structure des canaux construits par les protéines épineuses. Dans les expériences réalisées "in vitro" on a observé que plusieurs peptides synthétiques avec des séquences d'opération de plusieurs séquences de V3 sont capables d'inhiber l'entrée des peptides synthétiques.
Avec l'aide de la laitue, ces peptides peuvent être capables de freiner le processus de collecte du CD26. Afin de traiter les infections grippales, des médicaments sont conçus pour inhiber la libération de peptide de fusion d'hémaglutine. Ces médicaments se joindraient à la sous-unité HA2, près de la zone de localisation du peptide, et comme un bouchon, entraveraient le mouvement du peptide de fusion. Il existe des agents capables d'éviter la formation de pores lipidiques qui peuvent être utilisés pour entraver la fusion des membranes du virus et de la cellule.
La recherche sur l'entrée du virus vient de commencer. On peut penser que dans un essai scientifique continu vont apparaître de nombreux points d'inflexion. Au moment où la nature nous autorise, il est temps de concevoir une thérapie antivirale qui peut être utilisée chez les personnes. Cette thérapie pourrait être basée sur l'inhibition du processus d'entrée. Jusqu'à ce que ce moment arrive, ce qui est clair aujourd'hui est que dans le domaine de l'infection virale, agir sur un seul aspect de la recherche que le vaccin ne va pas à des points de tragédie possibles. Les efforts pour comprendre les mécanismes moléculaires de base impliqués dans l'introduction virale auront également une grande influence sur la recherche de thérapies possibles.

- un virus composé d'un acide nucléaire (ADN et ARN) et d'une couverture protéique.
- synthèse de deux autres molécules utilisant comme modèle une molécule d'ADN de réplication. Dans certains cas, faire des copies du virus lui-même.
- génome Ensemble de gènes propres à une espèce. Contrairement aux eucharistiques, dans les procaryotes, il est organisé en un chromosome unique.
- scories Ensemble de virus avec les mêmes caractéristiques génétiques et pathogènes.
- substance qui produit des anticorps après son introduction dans l'Organisme antigène.
- substance (immunoglobuline) produite par l'organisme après l'introduction de l'anticorps, qui participe au mécanisme d'immunité.
- Retrovirus Virus contenant de l'ARN comme matériel génétique, beaucoup de ces types de virus provoquent le cancer et de ce type est également la cause du sida.
- immunités cellulaires lymphocytes (globules blancs) et macrophages.
- glycoprotéine Dans sa composition, l'hétéroprotéine ou protéine complexe contenant, en plus des acides aminés, une molécule de sucre.
- immunogénique responsable immunitaire.
- endocité Assimilation de quelque chose extracellulaire à travers le processus appelé endocytose par une cellule.
- endosoma Composant non différencié du noyau cellulaire.
- molécule organique d'acides aminés carboxylique et de groupes aminés. Certains acides aminés sont des composants protéiques.
- peptide fusion Peptide qui met en œuvre le processus de fabrication d'une membrane de virus et une membrane cellulaire.
- molécule dans laquelle se produit l'union d'un nombre limité de peptides acides aminés.
- monomère Molécule capable de réagir avec ses égaux.
- monoclonal produit à partir du clone cellulaire lui-même.
- disposition tridimensionnelle d'autres atomes ou radicaux attachés à un atome de formage.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia