Estrategias del virus para la invasión celular
1996/01/01 Nieva, Jose Luis Iturria: Elhuyar aldizkaria
Los virus suelen situarse en el límite entre vivos y inertes. Los viriones no poseen maquinaria metabólica propia, es decir, no son capaces de construir por sí mismos sus componentes estructurales a partir de antecedentes metabólicos. Por ello, para poder reproducirse es necesario invadir a otros seres (huéspedes) y apropiarse de la maquinaria metabólica de las células de los mismos.
Dentro de la información genética que llevan los virus protegidos en su interior, se acumulan las órdenes para inhibir el metabolismo de la célula infectada y orientar la síntesis de los componentes del virus. Por lo tanto, los virus son parásitos moleculares que a veces pueden convertirse en depredadores y llevar a la muerte sin piedad al ser infectado.
Por lo tanto, para replicar, los virus son imprescindibles que su genoma (ADN o ARN) entre en el interior del huésped. El proceso que deben seguir para ello se denomina introducción. Dado que la entrada es obligatoria para poder producirse la lnección, esto tiene gran importancia en el ciclo de vida de los virus. En el caso de virus que penetran en células eucariotas, los viriones deben superar la cubierta molecular externa o membrana que rodea a la célula.
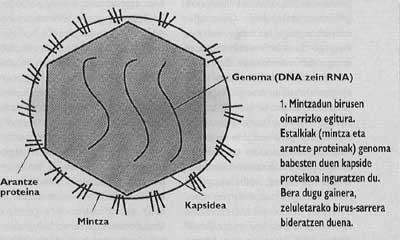
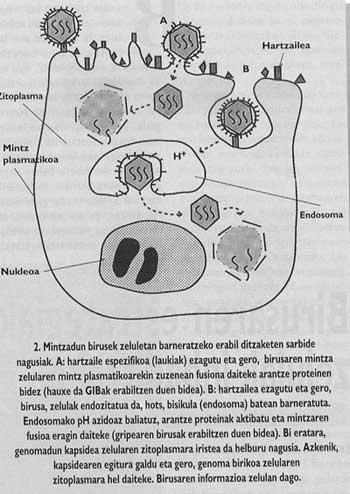
Asimismo, los animales y los virus más importantes con capacidad de infectar al hombre están rodeados de una membrana como la de las células llamadas cubiertas (Figura 1). Con el fin de orientar la entrada, estos virus han desarrollado mecanismos de integración con las cubiertas de las células que invadirán sus propias cubiertas. Una vez conseguida la fusión de las membranas de la célula de destino y el virión, el genoma del virus puede llegar al citoplasma de la célula (Figura 2) desde donde empezar a replicar.
Las estrategias de entrada desarrolladas por los virus encubiertos son procesos muy complejos que, para comprenderlos bien, los científicos están realizando constantes esfuerzos, ya que si pudiéramos aprender cómo evitar la entrada del enemigo asesinado estaríamos en vías de protección para ciertas infecciones. Con el objetivo de encontrar una forma sencilla y global de inhibir las infecciones víricas, los investigadores han buscado los elementos comunes de la entrada.
Desgraciadamente, las cosas no son tan sencillas como queramos. Como sabemos hasta ahora, al menos cada familia de virus ha ido desarrollando una estrategia de entrada diferente, por lo que la hipótesis de que existe un mecanismo de entrada general y común ha ido perdiendo fuerza. Además, las investigaciones sobre los mecanismos de entrada de virus todavía no han dado muchos resultados, ya que a principios de los años 80, cuando los científicos se dieron cuenta de que no era posible producir una vacuna universal contra el virus que produce la gripe, este campo comenzó a desarrollarse y puede considerarse de reciente creación.
En palabras del investigador español Rafael Blasco: "la investigación sobre cualquier virus está muerta en el momento en que se desarrolla la vacuna para tratar la enfermedad que provoca". El Sr. Blasco es el especialista más importante del Estado en la introducción de virus como el Poxvirus que crea la viruela. El virus de Navarra es el primer ser que los seres humanos hemos hecho desaparecer intencionadamente del planeta, por lo que Blasco dice que no hay demasiada responsabilidad sobre la entrada de sus familiares que se consideran poco importantes.
El error de este planteamiento se ha puesto de manifiesto en los últimos tiempos, sin saber cómo detener las plagas de gripe y SIDA. Hoy en día no es posible predecir el tipo de virus que provocará la siguiente epidemia. Para superar esta incapacidad, sería un paso importante desarrollar una terapia universal que sirviera para tratar cualquier infección vírica. Para ello también es necesario investigar en profundidad los procesos de entrada de virus. El virus de la gripe, por ejemplo, es especialista en trufar con nuestra protección inmunitaria. Para poder neutralizar también los virus y otros agentes extraños, las defensas del cuerpo humano deben conocer y diferenciar previamente a estos agentes extraños. Esto se consigue en la actualidad mediante vacunas. Las vacunas ponen de manifiesto la identidad de los agentes extraños a las defensas del cuerpo, de manera que se consigue que las células que van a producir anticuerpos que se deben unir a estos agentes estén listas antes de que se produzca la infección.
En el caso de la gripe, sin embargo, las cosas no son tan fáciles. Las vacunas antigripales tienen que ser modificadas anualmente, ya que cada escoria del virus de la gripe presenta antígenos diferentes (es decir, diferentes grupos de moléculas víricas que pueden identificar los anticuerpos). Es más, parece que el propio virus va a cambiar en las siguientes generaciones sabiendo que pone de manifiesto intencionadamente estas moléculas. De esta forma podemos producir anticuerpos frente al virus con facilidad, pero sólo el propio virus conocerá esas moléculas "maliciosamente expuestas".
En otras palabras, la protección que ofrecen las vacunas obtenidas mediante el uso de virus antiguos o de una escoria determinada no tiene valor frente a nuevos virus u otras escorias. Y por supuesto, la naturaleza o "identidad" del virus se puede cambiar casi anualmente. por otro lado, es evidente que los virus no hacen nada propio. Debido a su elevada tasa de replicación, los procesos selectivos suelen incidir con gran intensidad en los virus y su evolución suele ser esclava. En este proceso evolutivo los tipos de virus favorecidos son los más variables, ya que éstos suelen tener una mayor facilidad para superar los sistemas inmunitarios.
Así las cosas, los investigadores del Centro Mundial de Gripe, situado cada año en Atlanta, tratan de averiguar con entusiasmo la identidad del responsable de la próxima epidemia de gripe. Dos o tres meses antes de la llegada del invierno, el virus debe ser identificado, purificado y preparado en grandes cantidades. De lo contrario, una parte importante de la población formada por ancianos, enfermos crónicos y otros inmunodeprimidos estaría en peligro (indirectamente, la gripe provoca más muertes anuales que el SIDA). En el caso de la gripe, la importancia de encontrar una alternativa terapéutica diferente a la vacuna es evidente.
Pero el ejemplo más conocido de la falta de éxito de las vacunas es la vacuna contra el agente vírico del SIDA, que hoy goza de fama desgraciada. Este virus, denominado VIH (Virus de la Inmunodeficiencia Humana), es un virus de tipo retrovirus que en su ciclo de vida da un largo espacio integrado en las células de los huéspedes. Por lo tanto, tras entrar en el huésped, la información genética del virus puede ocultarse entre la información genética de la célula y mantenerse en estado latente durante varios años (se estima que esta situación puede durar varios años).
La principal defensa contra este tipo de virus es la detección y destrucción de células infectadas, es decir, el proceso denominado inmunidad celular. En muchas ocasiones, las células invadidas presentan en su piel fragmentos de agente extraño que, por decirlo de alguna manera, indican su estado. En estos casos, las células especializadas con función de lavado detectan estos "símbolos" y destruyen las células infectadas. Las células limpiadoras son células T citotóxicas. En situaciones infecciosas estas células necesitan de otras células intermediarias que permitan el crecimiento de los mismos.
Estas células, que cumplen la función de intermediarios especializados, son linfocitos cedente, más concretamente linfocitos tipo T4. Además, estos linfocitos son imprescindibles para coordinar otros homicidios inmunitarios. Desgraciadamente, los linfocitos T4 son presas favoritas del virus del VIH y este sistema defensivo no perfecto en sí mismo puede convertirse en más defectuoso si la infección por el VIH provoca la desaparición de los linfocitos T4 que actúan como intermediarios. Así, al llegar al colapso del sistema se produce una inmunodeficiencia que hace que el organismo quede desprotegido ante cualquier infección y pueda llegar a la muerte.
Este tipo de infección dificulta el desarrollo de la vacuna. Por un lado, la vacuna sería una cura poco eficaz para las personas infectadas, ya que los anticuerpos sólo podrán detectar virus ensamblados externos al trabajo celular (es decir, con cubierta), ya que el virus VIH en latencia es indetectable para nuestras defensas. Por otro lado, las vacunas más efectivas hasta el momento han sido las preparadas con virus más débiles, es decir, vacunas que pueden causar infecciones a pequeña escala. Obviamente, a una persona sana no se le puede administrar este tipo de vacuna de VIH, ya que el riesgo de infección irreversible y mortal es excesivo.
Para superar esta barrera, actualmente se están estudiando vacunas sintéticas y recombinantes. Aunque ambos modelos de vacunas están en fase de ensayo, para ser eficaces en el futuro deberán superar un gran obstáculo: al igual que en el caso de la gripe, las características inmunogénicas más destacadas del VIH son a la vez las más cambiantes, de las que parecen mostrar intencionadamente el propio virus. Si pudiéramos diferenciar las partes inmunogénicas inalterables, tendríamos más posibilidades de preparar una vacuna eficaz. Para ello y como veremos más adelante, es necesario investigar en profundidad la biología del virus. Mientras tanto y en un futuro cercano, la vacuna contra el VIH parece un sueño. Así lo confirmaron los expertos que se acercaron al Congreso Mundial de SIDA que se celebró en Osaka a principios de agosto de 1994.
El problema de las pandemias de gripe y sida nos lleva a investigar la biología de los virus que provocan estas enfermedades. Ambos son virus con cubierta, es decir, rodeados de una membrana lipídica como las membranas celulares (Figura 1). De hecho, los viriones roban la membrana de la célula que ellos han nacido. Sin embargo, las membranas de los virus no contienen las mismas proteínas que la membrana celular, sino las glicoproteínas víricas especiales llamadas proteínas espinosas. En estas proteínas específicas podría estar el cuello de la lucha contra los virus como la gripe y el VIH.
En palabras de judith White, el mayor especialista del mundo en la introducción del virus de la gripe: "Las proteínas de espinas son máquinas esenciales para la entrada, ya que estas proteínas polivalentes son las que engañan al sistema inmunitario, conocen al receptor celular que limita el tropismo celular (qué tipo de célula se va a invadir) y son superiores para desempeñar las funciones de fusionar la membrana celular y vírica". Como se verá más adelante, estas proteínas son esenciales en este proceso, ya que el bloqueo de cualquiera de estas funciones podría poner en peligro la capacidad de penetración celular de los viriones.
Intentar frenar la entrada puede ser un buen método en la lucha contra la infección vírica. Para ello necesitamos un buen conocimiento de la función y estructura de las proteínas espinosas. Una vez conocidas las partes funcionales de estas proteínas y aclarados los factores necesarios para su inclusión en el huésped, podemos empezar a diseñar vías que permitan la interrupción de la entrada. Las proteínas espinosas de la cubierta del VIH y los virus de la gripe son paradigmáticas en este sentido. Su estructura y funciones son las más investigadas (Figuras 3-5).
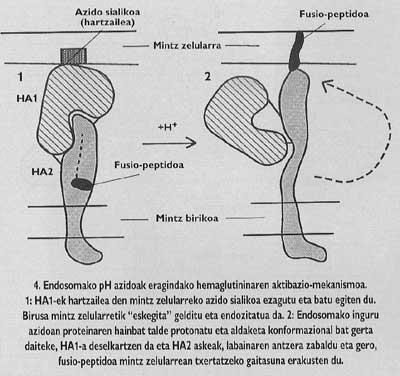
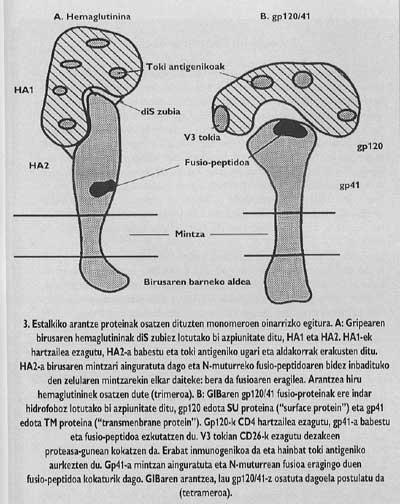
Estas proteínas de membrana tienen una estructura oligómica, es decir, están formadas por diferentes módulos. La proteína espina del virus de la gripe, la hemaglutinina, es heterotrimero, es decir, está construida con tres monómeros formados por dos subunidades diferentes, HA1 y HA2. La subunidad de la capilla es ha1 y la subunidad con péptido de fusión es ha2. Esta última es la que al activarse con el pH ácido del endosoma, hace aparecer el péptido de fusión y se integra en la membrana de la célula de destino.
La proteína de espino del VIH es tetrámero, es decir, está formada por cuatro monómeros llamados gp120/41. En este virus, la activación de la subunidad con péptido de fusión (llamado gp/41) es totalmente diferente al virus de la gripe. Para que se produzca la activación hay que liberar esta subunidad de la subunidad denominada gp120 que se encuentra en el sombrero, siguiendo un mecanismo que hasta el año pasado no estaba del todo claro, se suelta el Gp41 en dos pasos. En la primera se conoce y se integra el receptor CD4 del linfocito gp120. El conocimiento del CD4 es imprescindible para iniciar el proceso de fusión entre membranas, pero no activa la subunidad fusogénica. Los lkerlaris comprobaron que GlBa no infecta células de ratas con un receptor CD4 similar al humano generado por una ingeniería genética, a pesar de que estas células mutantes demostraron su capacidad de adhesión al virus equivalente al linfocito T4.
Es decir, aunque este receptor CD4 de células ratas mutantes funcionaba como en el ser humano (era capaz de unirse al virus), su adhesión al receptor no era suficiente para encauzar la fusión. Por tanto, además del receptor CD4, otro factor misterioso debía influir en las membranas de los linfocitos T4 humanos para que estas células fueran sensibles al VIH. Por ello, se postuló que el VIH debía tener un segundo receptor específico. En otoño de 1993, el equipo de Ara Hovanessia del Instituto Pasteur descubrió que había identificado a este destinatario.
Antiguamente se conocía que los anticuerpos monofuncionales creados contra el lugar antigénico V3 (Figura 3) en la superficie del Gp120 podían detener la infección. El posible éxito de las vacunas sintéticas basadas en el GP120 que actualmente se está tratando dependería de la protección que podrían ofrecer anticuerpos capaces de conocer este lugar. En este lugar hay una secuencia permanente de aminoácidos, es decir, una secuencia de aminoácidos que no cambia de generación en generación. ¿Por qué ese lugar es especial? Esta secuencia permanente es la secuencia "consensus". Las proteasas son enzimas que dividen las proteínas. Sin embargo, las enzimas no cortan por doquier la cadena proteica, sino por los lugares donde hay determinadas secuencias de aminoácidos. Estas secuencias se denominan consensus.
Cada tipo de proteasa sólo conoce una secuencia de "consensus". La secuencia en V3 sólo puede conocer unas proteasas especiales del ser humano y una de ellas es la molécula receptora denominada CD26 que se encuentra en la superficie del linfocito T4. El equipo del Instituto Pasteur demostró que para entrar en el hostal, el VIH necesita la actividad proteásica del CD26. En su defecto no hay infección. Es más, los anticuerpos monofuncionales fabricados contra el CD26 (que sólo se pueden fusionar con el CD26) eran capaces de evitar la entrada del VIH en cualquier tipo de célula. Además, si las células que normalmente no contienen CD4 ni CD26 provocan la producción de estas moléculas, los científicos de este grupo reivindicaron que cualquier tipo de célula era sensible a la infección por VIH.
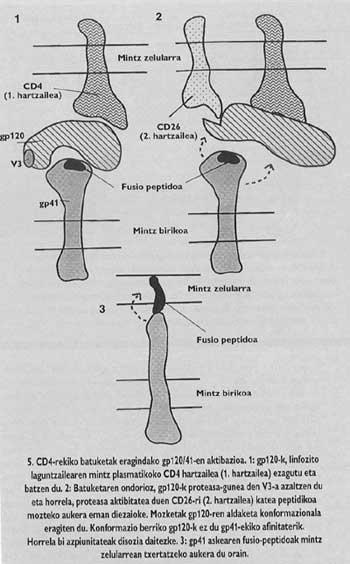
Ese sería, por tanto, el factor misterioso que hemos mencionado. Según este hallazgo, en el segundo paso del mecanismo de activación del GP41 que se propone en la actualidad, el CD26 cortaría la cadena proteica en el lugar V3 del GP120 que estaba unido a CD4. El corte supondría un cambio en el conformado de GP120, lo que supondría una disminución de la afinidad con GP41. La pérdida de afinidad provocaría la liberación del gp41 alrededor de la membrana de la célula de destino. De esta forma se asegura la correcta inserción del péptido de fusión.
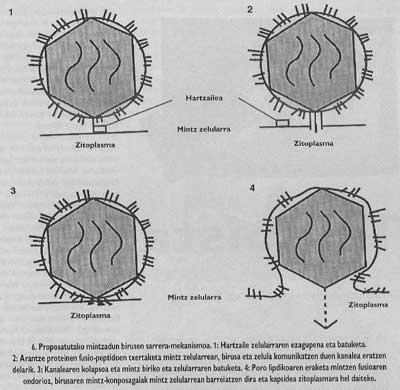
El esquema general de la entrada sigue sin completarse. Aunque sabemos que la unión al receptor y la introducción de péptidos de fusión son pasos necesarios, todavía no sabemos cómo se realiza la fusión entre el virus y las membranas de la célula de destino. Sin embargo, los datos experimentales que tenemos en este momento nos indican que el mecanismo inespecífico (Figura 6) sería el siguiente: una vez insertados los péptidos de fusión, el virus de la espina que ha producido la fusión forma un canal que puede comunicar la célula (este paso puede decir que tiene una gran base experimental) y posteriormente, gracias a un mecanismo aún no claro, el canalón sufre un colapso y, por último, la membrana del virus y el lipídico. Una vez abierto el poro, la cápsida del virus puede llegar al citomopiámara de la célula.
Todavía no sabemos en qué medida nos serán útiles estos procesos generales para inhibir la entrada de virus, pero podemos ir trabajando en posibles vías para llevar a cabo esta hipotética inhibición. Asimismo, a medida que se vayan aclarando los detalles de los mecanismos básicos del proceso, la posibilidad de encontrar soluciones será cada vez mayor. De hecho, intentar inhibir el proceso de entrada descrito no es una simple ocurrencia, sino una realidad que ya se está poniendo en práctica en la actualidad. Con el objetivo de frenar la infección del VIH, ya se están utilizando las fracciones solubles del receptor CD4 como base de una terapia.
Los investigadores creen que los viriones se unirán a estas fracciones y se inactivarán. Como ya se ha mencionado anteriormente, varias vacunas sintéticas basadas en el GP120 intentan esperar que los anticuerpos contra los lugares inmunológicos de este péptido sean capaces de frenar la infección del VIH. Los estudios "in vitro" han demostrado que los péptidos de fusión obtenidos mediante síntesis química pueden evitar la entrada del VIH. No se sabe aún cuál puede ser la causa de esta inhibición, pero es posible que estos péptidos libres provoquen distorsiones en la estructura de los canales construidos por las proteínas espinosas. En los experimentos realizados "in vitro" se ha observado que varios péptidos sintéticos con secuencias de operación de varias secuencias de V3 son capaces de inhibir la entrada de péptidos sintéticos.
Con la ayuda de la lechuga, estos péptidos pueden ser capaces de frenar el proceso de recogida del CD26. Con el objetivo de tratar infecciones gripales, se están diseñando fármacos capaces de inhibir la liberación de péptido de fusión de hemaglutina. Estos fármacos se unirían a la subunidad HA2, cerca de la zona de ubicación del péptido, y como un tapón, dificultarían el movimiento del péptido de fusión. Existen agentes capaces de evitar la formación de poros lipídicos que pueden ser utilizados para dificultar la fusión de las membranas del virus y de la célula.
La investigación sobre la entrada del virus acaba de comenzar. Se puede pensar que en un ensayo científico continuo van a aparecer muchos puntos de inflexión. En el momento en que la naturaleza nos autorice, llega la hora de diseñar una terapia antiviral que se pueda utilizar en las personas. Esta terapia podría estar basada en la inhibición del proceso de entrada. Hasta que llegue ese momento, lo que está claro hoy en día es que en el campo de la infección vírica, actuar en un solo aspecto de la investigación como la vacuna no va a posibles puntos de tragedia. Los esfuerzos por comprender los mecanismos moleculares básicos que intervienen en la introducción vírica también tendrán una gran influencia en la búsqueda de posibles terapias.

- todo un virus
compuesto por un Ácido Nuclear (ADN y ARN) y una cubierta proteica. - síntesis de otras dos moléculas utilizando como modelo una molécula de
ADN de replicación. En algunos casos, hacer copias del propio virus. - genoma
Conjunto de genes propios de una especie. A diferencia de los eucaríticos, en los procariotas está organizado en un único cromosoma. - escorias
Conjunto de virus con las mismas características genéticas y patógenas. - sustancia que
produce anticuerpos tras su introducción en el Organismo Antígeno. - sustancia (inmunoglobulina)
producida por el organismo tras la introducción del anticuerpo, que participa en el mecanismo de inmunidad. - Retrovirus Virus que contiene ARN como
material genético, muchos de estos tipos de virus provocan cáncer y de este tipo es también el causante del SIDA. - inmunidad obtenida
por inmunidades celulares linfocitas (glóbulos blancos) y macrófagos. - glicoproteína
En su composición, la heteroproteína o proteína compleja que contiene, además de aminoácidos, una molécula de azúcar. - inmunogénico
Responsable inmune. - endocitad
Asimilación de algo extracelular a través del proceso denominado endocitosis por una célula.
endosoma Componente no diferenciado del núcleo celular.- molécula
orgánica de aminoácidos carboxilo y grupos aminos. Algunos aminoácidos son componentes de proteínas. - péptido de
fusión Péptido que pone en marcha el proceso de elaboración de una membrana de virus y una membrana celular. - molécula en la que se produce la unión de un número
limitado de péptidos Aminoácidos. - monómero
Molécula capaz de reaccionar con sus iguales. - monoclonal producido a
partir del propio clon celular. - disposición
tridimensional de otros átomos o radicales unidos a un átomo de conformado.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia