Si a xestación cura o corazón?
2018/03/01 Redondo Angulo, Ibon - Biomedikuntzan doktorea Iturria: Elhuyar aldizkaria
O corazón dos mamíferos ten como única función bombear o sangue a través do aparello circulatorio paira facer chegar ao propio corazón e ao resto dos órganos os nutrientes e o osíxeno. A tarefa é única, pero non lenta. As situacións que se dan ao longo da vida animal presentan esixencias enerxéticas moi variadas que o corazón debe cumprir.
Paira satisfacer estas maiores esixencias enerxéticas, o corazón ten que traballar máis e iso ten una consecuencia: máis tensión nas paredes do corazón. Si este incremento persiste durante un período de tempo, o corazón pode pór en marcha un mecanismo paira reducir a tensión ventricular e manter ou aumentar a capacidade de bombeo. Lamentablemente o nome do mecanismo é coñecido: a hipertrofia cardíaca.
Hipertrofia cardíaca
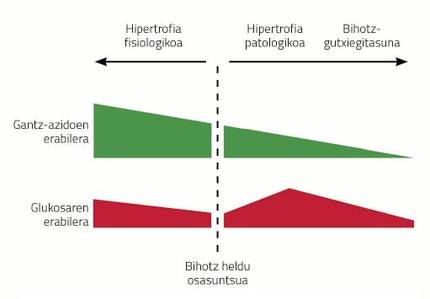
A hipertrofia cardíaca é consecuencia de enfermidades como a hipertensión, o infarto producido pola isquemia das arterias coronarias ou a obesidade. Este tipo de hipertrofias denomínanse hipertrofias patolóxicas e teñen certas características. Por exemplo, o metabolismo do corazón cambia radicalmente coa hipertrofia do corazón. A diferenza do cerebro, o corazón utiliza principalmente acedos grasos (60-70%) como fonte de enerxía e o resto obteno do metabolismo da glicosa. Ao enfermar o corazón, o uso das fontes de enerxía cambia radicalmente; a glicosa convértese na principal fonte de enerxía no corazón hipertrofiado e os ácidos grasos descártanse. Si a tensión crónica que recibe o corazón hipertrofiado non desaparece, o corazón aumenta aínda máis, aparece máis fibrosis e prodúcese inflamación diminuíndo a capacidade de bombeo. Ademais, a medida que a enfermidade avanza, o corazón deixa de utilizar glicosa, característica da insuficiencia cardíaca.
As enfermidades cardiovasculares son as máis frecuentes na sociedade actual e moitas delas teñen o síntoma dun aumento do corazón. A hipertrofia cardíaca transfórmase a miúdo nunha insuficiencia cardíaca que, desgraciadamente, aínda non ten remedio. Por iso, a insuficiencia cardíaca é una das causas máis comúns de morte nas sociedades industrializadas.
En numerosos estudos biomédicos nesta materia están a ensaiarse paira descubrir e comprender os mecanismos moleculares mediante os cales a hipertrofia cardíaca convértese en insuficiencia cardíaca. Desta forma poderíanse desenvolver novos episodios terapéuticos paira evitar a hipertrofia do corazón ou para que o corazón hipertrofiado volva ao seu estado san, todo paira evitar a insuficiencia cardíaca. Pero por onde empezar, como facer un órgano hipertrofiado paira volver á súa función e estado anatómico normal? Paira iso non debemos buscar moi lonxe ou en profundidade, as femias poden ter resposta, as femias gestantes.
Hipertrofia cardíaca por xestación
A xestación é un proceso complexo, mesmo biolóxico. A fecundación inicia numerosos cambios profundos no organismo dunha femia. Todos estes cambios van permitir que da unión das dúas células xurda un novo membro dunha especie.
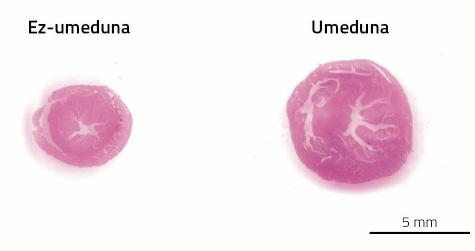
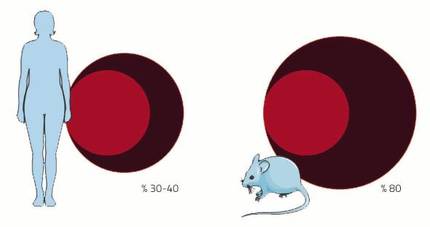
O sistema cardiovascular é un dos sistemas que sufrirá moitos cambios durante a xestación. A causa é a placenta. Coma se fose pouco o nacemento dun novo neno, a xestación ten outro feito marabilloso: crear un novo órgano dentro dun corpo adulto. Este novo órgano necesita, do mesmo xeito que o resto, unha subministración de sangue. Paira iso, a rede arterial e venosa prolongarase até a plazenta paira fornecer sangue á placenta. Ademais, incrementarase o volume de sangue paira encher o novo aparello de circulación prolongado. Nas mulleres o volume de sangue aumenta entre un 30-40%, case o dobre que no rato un 80%. E é que, como en cada xestación os ratos teñen tantas placentas como crías, a súa demanda de sangue é maior.
O problema é que o corazón ten que bombear máis sangue desde un sistema de tubaxes de arterias e veas máis longo. Como se comentou anteriormente, a xestación é una das situacións da vida animal nas que o corazón ten que traballar máis. Como consecuencia, as femias gestantes desenvolven una hipertrofia cardíaca. Este tipo de hipertrofia, pola súa banda, denomínase beneficiosa ou fisiológica. Neste caso, o corazón non expresa fibrosidad, e o metabolismo non selecciona glicosa senón todo o contrario, baséase máis en ácidos grasos (ver figura 3).
Tras o parto, do mesmo xeito que a placenta, os cambios fisiológicos derivados do embarazo desaparecen. Tamén hipertrofia do corazón. No caso dos ratos, entre 7 e 14 días despois do parto, o corazón é capaz de recuperar o seu tamaño orixinal; nas mulleres o proceso alárgase durante un ano.
Aí está a cuestión. Como exclúe o corazón dunha femia gestante de hipertrofia? Por que non é posible restaurar a hipertrofia cardíaca que se produce en varias enfermidades? Que podemos aprender da hipertrofia beneficiosa da xestación paira curar hipertrofias patolóxicas? En resposta a todo iso, as investigacións realizadas no noso laboratorio describiron 2 factores relacionados coa hipertrofia gestacional:
? O primeiro factor é o FGF21, factor de crecemento dos fibroblastos 21. No ano 2000 un grupo de científicos xaponeses descubriu este factor como hormona. O factor FGF21 xérase principalmente no fígado, despois viaxa polo sangue até chegar á súa tecidos diana, onde produce diversos efectos. Uno deles é o tecido adiposo marrón ou graxa parda. Esta hormona promove o consumo de ácidos grasos. En xeral, o FGF21 é un factor capaz de estimular o metabolismo, polo que quizá a hormona presentouse tamén como fumador de graxas. Algúns laboratorios tamén traballan paira utilizalas como ferramenta anti-diabetes. Os roedores diabéticos tratados con FGF21 presentaban mellores niveis de glicosa ou glucemias, á vez que recuperaban a sensibilidade á insulina perdida e reducían o peso e os triglicéridos en sangue.
A relación entre FGF21 e o corazón foi descoñecida até fai 5 anos. Entón publicamos como o FGF21 era beneficioso tamén paira o corazón. Aos ratos xeróuselles una hipertrofia patolóxica do corazón mediante un fármaco. Nestes corazóns aparecía a fibrosis, a inflamación e a indicación restrinxida dos xenes que rexen o consumo de ácidos grasos. A outro grupo de rato, ademais do fármaco, inseríuselles o FGF21, o que provocou una menor hipertrofia cardíaca. O grao de inflamación e a expresión dos xenes tamén mellorara respecto dos animais que só recibiron o fármaco. Ademais, entre os descubrimentos, demostramos que o corazón ten a capacidade de producir FGF21, o que permitiría ao corazón influír nel o FGF21 que el mesmo creou.
Durante a xestación prodúcese una maior expresión fisiológica do FGF21. O fígado e tamén o corazón xeran un factor, polo que o grao de FGF21 medible no sangue dunha femia gestante é moito maior que o dunha femia non gestante. Ademais, atendendo ao consumo de ácidos grasos do corazón, durante a xestación é moito maior, o que supón una hipertrofia beneficiosa. Noutro grupo de experimentos traballouse con ratos incapacitados paira crear o FGF21, de maneira que, a pesar de estar esperto, as femias non podían aumentar o nivel sanguíneo do factor. Diso deduciuse que a capacidade de utilizar ácidos grasos estaba reducida. O FGF21, por tanto, é necesario paira levar a cabo a sobrecarga de traballo que a xestación esixe ao corazón, xa que o corazón necesita FGF21 paira consumir máis acedos grasos.
? O segundo factor descrito é un factor de transcrición cuxa función é canalizar a expresión doutros xenes. Ao analizar as femias gestantes, destacamos que a presenza deste segundo factor era só no corazón. Ao ser tan específica esta sobreexpresión do corazón, pareceunos que había que ter una razón detrás. O factor C/EBPb é un factor estreitamente relacionado coa resposta inmune e a inflamación, xa que é clave paira a activación de macrófagos. Os macrofagos son células que interveñen no proceso inflamatorio e poden ser de dous tipos: proinflamatorios (tipo M1), que iniciarán o proceso e antiinflamatorios (tipo M2), que resistirán o proceso.
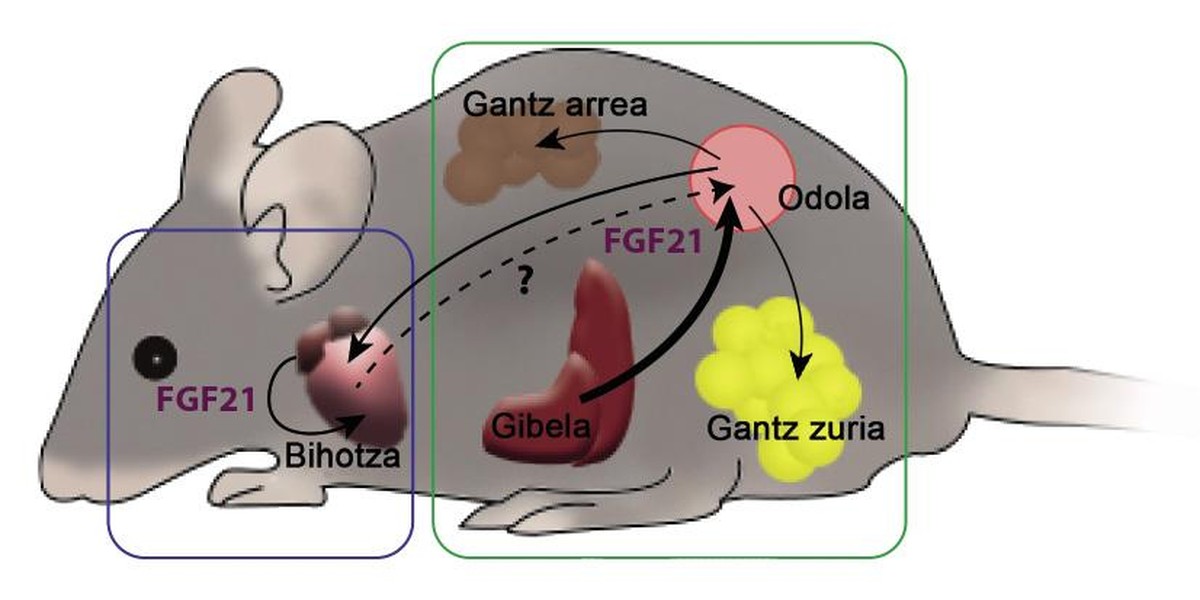
Como xa se indicou, no caso de hipertrofias patolóxicas pódese observar fibrosis e inflamación nos corazóns, non así nas hipertrofias fisiológicas. No caso da xestación describiuse que, sendo beneficiosa, a presenza de macrófagos tipo M2 era maior que a de tipo M1. Si ás femias gestantes quítaselle a metade da capacidade de usar C/NFU, ocorre o contrario nos corazóns: Predominan os macrófagos tipo M1. O corazón necesita C/EBPb paira activar os M2 macrófagos e combater a inflamación.
O corazón ten, por tanto, mecanismos e camiños paira facer beneficiosa una situación que debería ser patolóxica e permitir una carga de traballo máis elevada do normal, así como a posterior eliminación da hipertrofia. É máis, estes mecanismos de fecundación e os demais que están por descubrir son capaces de protexer o corazón. Un par de estudos revela como os corazóns de roedores nenos eran máis resistentes a un fármaco que produce fibrosis, e como os danos producidos tras un infarto eran menores nos nenos.
Cabe destacar que a maior parte da investigación biomédica que se realiza con ratas e ratos realízase con animais machos, xa sexa porque sempre se fixo así ou porque as femias deben gardarse paira ter crías. A pesar diso, neste exemplo as femias foron a clave do avance cara á hipertrofia e a insuficiencia cardíaca, xa que elas son as únicas que achegaron a xestación.
Bibliografía
Traballo presentado aos premios CAF-Elhuyar.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia