Adipocytes, obésité et santé: relation plus complexe que prévu
2020/12/01 Milton Laskibar, Iñaki - Nutrizioa eta Obesitatea ikerketa taldea (EHU) CIBEROBN eta BIOARABA Osasun Institutuak | Maria Puy Portillo Baquedano - Nutrizioa eta Obesitatea taldea, EHU. CIBERobn, Carlos III Osasun Institutua. BIOARABA Osasunaren Ikerketa Zentroa Iturria: Elhuyar aldizkaria

Mais commençons par le début. L'obésité est une maladie chronique caractérisée par une accumulation excessive de graisse qui peut être préjudiciable à la santé. Bien qu'il s'agisse d'une maladie multifactorielle, les habitudes alimentaires et les facteurs environnementaux sont considérés comme des facteurs principaux (mode de vie sédentaire et ingestion énergétique excessive) [1]. Le développement de l'obésité nécessite un déséquilibre entre la consommation et les dépenses énergétiques, qui s'allonge dans le temps. Cet excès d'énergie s'accumule dans les unités fonctionnelles du tissu adipeux, adipocytes, sous forme de triglycérides, au moyen de deux mécanismes : l'hypertrophie des adipocytes (augmentation de taille des adipocytes pour accumuler des excédents énergétiques) et l'hyperplasie des adipocytes (augmentation du nombre d'adipocytes). Bien que nous connaissions depuis longtemps le rôle des adipocytes dans l'accumulation d'énergie, nous n'avons fait que prendre conscience de l'importance de ces cellules de tissu adipeux dans le maintien de l'homéostasie métabolique du corps [2].
En général, la capacité d'hypertrophie des adipocytes est liée à l'obésité qui se développe à l'âge adulte, tandis que l'hyperplasie a été considérée comme le moteur de l'obésité infantile et juvénile. En fait, on pensait jusqu'à récemment que le nombre d'adipocytes d'un tissu gras était limité et maintenu constant de l'enfance à la maturité [3]. Cependant, des études récentes avec des rongeurs ont montré que, à l'âge adulte, de nouveaux devinettes se produisent également en abusant de l'énergie. Ces nouveaux adipocytes proviennent de la différenciation des adipocytes immatures et participent à la diffusion du tissu adipeux (hyperplasie) [4]. Mais, malgré cela, quelle est la relation avec la santé avec l'hypertrophie et l'hyperplasie des adipocytes?
Car grand. Quand une hypertrophie des adipocytes se produit, les adipocytes grandissent de taille jusqu'à ce qu'ils touchent. Dans cette situation, la diffusion de l'oxygène est également bloquée et les adipocytes subissent un état d'hypoxie [5]. D'autre part, à ces devinettes où ils se trouvent hypertrophiés s'ajoutent aussi les macrophages inflammatoires. Ainsi, le tissu adipeux sécrète des cytokines inflammatoires du sang, comme les interleukines 6 et 8 (IL-6 et IL-8), la protéine 1 monocytaire (MCP1) et le facteur de nécrose tumorale (TNF) [6]. Tous ces processus entraîneront une inflammation chronique à bas niveau qui provoquera des perturbations dans le fonctionnement normal des adipocytes (figure 1). D'une part, la lipolyse est intensifiée à l'état basal des adipocytes (mobilisation des graisses de réserve) et plus d'acides gras sont libérés dans le sang. Ces acides gras libres seront accumulés dans des organes et des tissus autres que le tissu adipeux, sous forme de triglycérides, principalement dans le foie et les muscles, ce qui est appelé lipotoxicité. Certaines études ont montré que les niveaux plus élevés d'acides gras libres sont associés au développement de la résistance à l'insuline et à la stéatose hépatique (accumulation excessive de graisse dans le foie) [7]. En outre, la production d'agents inflammatoires du cytokine mentionné ci-dessus empêchera l'adipogenèse. Par conséquent, la différenciation des adipocytes immatures sera plus limitée et moins de nouveaux adipocytes seront générés [8]. Tous ces faits nous mèneront au contexte qui s'explique au début de ce paragraphe, en entrant dans un cercle vicieux, apparemment sans solution.
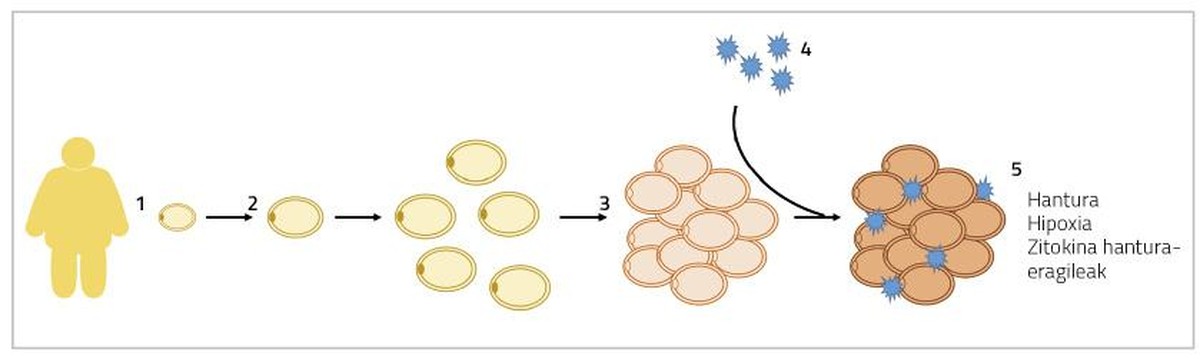
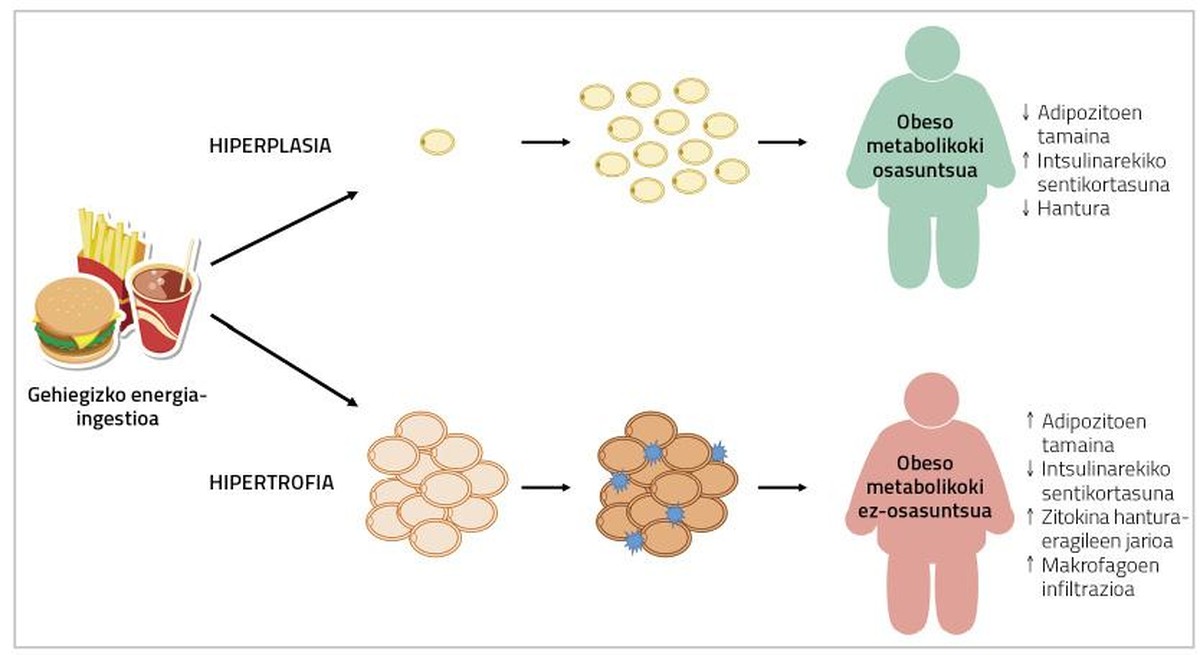
En cas d'hyperplasie des adipocytes, les excédents énergétiques s'accumuleront dans de nouveaux devinettes, diminuant la présence de devinettes hypertrophiées. En conséquence, le flux de cytokines inflammatoires diminuera également [5]. D'autre part, la formation d'adipocytes plus petits a été liée à l'angiogenèse (formation de nouveaux vaisseaux sanguins), qui évitera l'hypoxie des adipocytes et l'inflammation des tissus adipeux associés [9]. À cet égard, il a été observé que les souris génétiquement affectées par l'adipogenèse indéfinie du pourcentage de graisse sont métaboliquement saines quand elles se nourrissent de régimes d'engraissement. Chez les humains, on a trouvé quelque chose de semblable.
En fait, les pourcentages adipocytes de graisse chez les personnes atteintes du syndrome métabolique présentent une infiltration d'hypertrophie, d'hypoxie et de macrophages; et d'autre part, dans le tissu adipeux de personnes obèses et métaboliquement saines, on a décrit des adipocytes de plus petite taille et un plus grand nombre de vaisseaux sanguins (figure 2) [2]. Par conséquent, une solution au problème peut être de provoquer l'adipogenèse chez les personnes obèses. De cette façon, ces personnes développeraient des adipocytes mineurs et auraient donc moins de risques de maladies métaboliques.
Malheureusement, ce n'est pas si simple. En fait, selon le tissu gras, les adipocytes qui peuvent être trouvés en elle sont différents. Par exemple, le tissu adipeux viscéral augmente par hypertrophie, tandis que le tissu adipeux sous-cutané tend à hyperplasie. En outre, la capacité des dépôts de graisse pour l'adipogenèse diffère des stimuli qui l'induisent [2]. Des études menées avec les rongeurs ont montré que l'activation de l'adipogenèse génétiquement induite provoque le développement d'adipocytes de plus petite taille dans les souches transgéniques (sans influencer la teneur en graisse corporelle ni le poids) et qu'ils deviennent métaboliquement plus sains [7]. Dans le cas des êtres humains, bien qu'ils n'aient pas fait ce genre de travail, on a décrit quelque chose de semblable avec le médicament tiazolidinediona (DGT) utilisé pour le traitement du diabète de type 2. Ceci est dû au fait que, en plus d'améliorer le diabète, il produit une augmentation du tissu adipeux, une diminution de la taille des adipocytes locaux et une diminution du flux d'agents inflammatoires de cytokine. Contrairement aux animaux, l'amélioration métabolique que produisent ces médicaments coïncide avec l'augmentation du poids corporel [10]. Cependant, il reste à voir s'il est possible de produire l'adipogenèse chez les humains adultes sans effets nocifs sur le poids corporel ou d'autres processus métaboliques. Dans ce contexte, il convient de noter que de nombreuses études menées à ce jour autour de l'adipogenèse ont été visant à inhiber l'adipogenèse elle-même. En fait, en testant des molécules et des composés qui peuvent convenir pour traiter l'obésité, on étudie leur capacité à inhiber l'adipogenèse. Et la vérité est que cela a son sens: si moins de devinettes se produisent, il sera difficile de répandre le tissu gras (et donc l'obésité).
Comme vous pouvez le constater, il reste encore beaucoup de chemin à parcourir pour obtenir un traitement médicamenteux efficace de l'obésité. Bien que le concept d'obèse soit apparemment attrayant (et raisonnable), métaboliquement sain, il n'existe pas de consensus absolu entre les chercheurs sur les conséquences pour la santé de cette situation. Bien comprendre le développement de tissus gras anatomiquement différents peut aider à modifier la distribution de graisse corporelle ou le fonctionnement du tissu adipeux chez les personnes obèses. Cependant, il est encore clair que la prévention est l'intervention la plus efficace contre l'obésité.
Bibliographie Bibliographie
Travail présenté aux prix CAF-Elhuyar.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia