Prions, gardien de la mémoire
2017/03/01 Agirre Ruiz de Arkaute, Aitziber - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
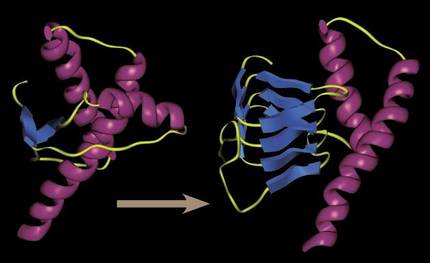
Il y a 30 ans, il était inimaginable de parler d’un système organique infectieux capable de se reproduire sans ADN ou ARN. Tous les systèmes infectieux avaient des structures génétiques pour augmenter l'infection et la prolifération de virus, les agents infectieux les plus simples encore connus. Mais les prions ont prouvé qu'il était possible : des protéines simples repliées à tort étaient capables de contaminer les protéines de l'environnement par leur mauvais pliage. Par contact, pas besoin de se reproduire.
Ils réussissaient à altérer la forme tridimensionnelle des protéines fonctionnelles qui les accompagnaient, et s'il s'agissait d'une forme tridimensionnelle engendrée de caractère désengourdissant, les prions tendaient à se rassembler en créant des agrégats toujours plus grands et entravant les processus cellulaires.
Les maladies provoquées par les prions ont déclenché l'alarme dès le début, dans la crise des vaches folles, lorsque la communauté scientifique est restée sans voix devant cette nouvelle forme d'infection. Le simple fait d'être des prions était passionnant du point de vue biologique, on ne pouvait pas le nier, mais en même temps c'était terrifiant. Ils ne savaient pas par où aborder les infections provoquées par les prions. En outre, il a été observé qu'ils peuvent être à la base de nombreuses maladies neurodégénératives, comme la maladie d'Alzheimer et le parkinson.
Cependant, après de nombreuses études, le visage amical des prions a commencé à émerger: prions non pathogènes, créatrices d'agrégats et avec des tâches spécifiques dans notre corps.
Mémoire à long terme aux mains des prions
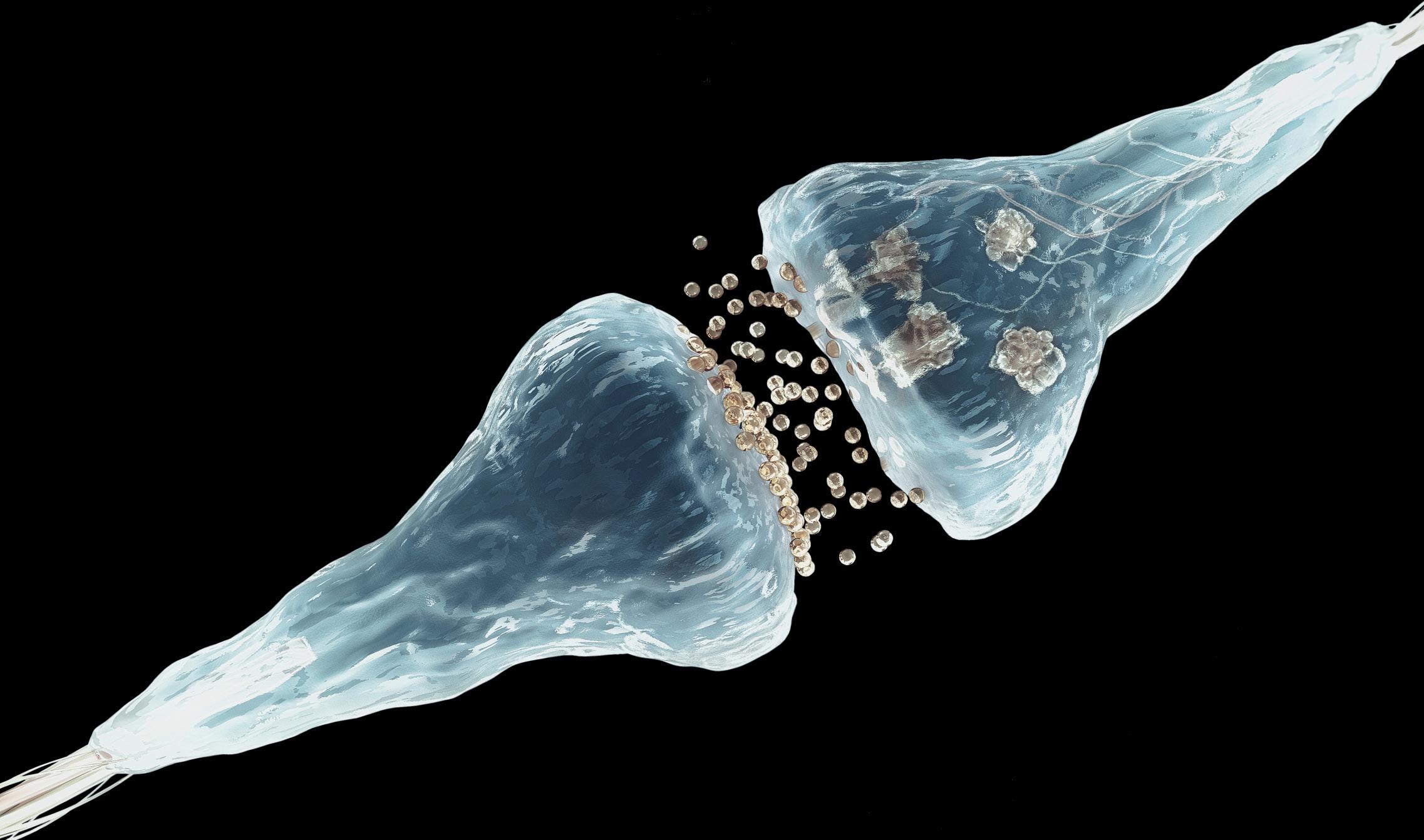
Si nous regardons le cerveau, nous verrons des milliards de neurones, chacun avec beaucoup de synapses. Dans ces synapses on fixe la mémoire, grâce à elles nous gardons chimiquement les souvenirs. Francis Crick, l'un des découvreurs de la structure de l'ADN, a cependant exprimé il y a 20 ans une préoccupation : comment est-il possible que les souvenirs restent beaucoup plus longtemps que les protéines restent dans les cellules vivantes? Si les protéines des synapses durent deux mois, comment peut-on conserver chimiquement un souvenir pendant des années ? Comment une synapse peut-elle être stabilisée pour toujours ?
Crick prévoyait la présence d'une protéine qui est en quelque sorte ajoutée dans ce processus. Étant ajouté, il n'aurait pas la capacité de mouvement, et cela pourrait être la façon de stabiliser une synapse donnée.
Puis ils ont vu que dans les synapses apparaissaient des prions et ont commencé à expérimenter pour former les souris à traverser un labyrinthe encore et encore, jusqu'à ce que cette expérience se consolide comme un souvenir à long terme. Grâce à l'ingénierie génétique, ils ont réduit au silence le gène du prion CPEB, typique des symapses neuronales, et les résultats ont été étonnants: deux semaines après la consolidation du souvenir avait déjà disparu.
La même chose a été observée dans les mouches de vinaigre. Si une femelle ne montre pas de position de copulation par rapport à un mâle donné, ce mâle le rappellera et ne réessayera pas, même s'il a passé beaucoup de temps. En changeant la protéine Orb2 qui agit comme un prion, à partir d'un seul jour, les souvenirs deviennent instables ; après trois jours, ils ont complètement disparu. Le mâle tentera à nouveau de la couvrir.
De là, ils ont vu que les prions servent à renforcer et stabiliser les synapses neuronales, ce qui permet de maintenir la mémoire à long terme. Les prions semblent idéales pour ce travail. En fait, ils créent des structures polymères très stables dans le temps et leur conversion est autosuffisante: quand un prion change son pliage, les protéines environnantes continueront à changer automatiquement leur pliage. Ce processus par contagion de prions résout le problème de Crick, car au-delà du stimulus initial du neurone, ils continueront à créer des chaînes agrégées sans autres stimuli. Cela maintiendra constamment la synapse et donc le souvenir.
Mais nous ne gardons pas tous les souvenirs pour toujours. Le neurone, avec une régulation stricte, sépare les circuits neuronaux stabilisés et non. Quand il reçoit le pouls électrique, dans une danse biochimique complexe qui ne se produit que dans cette synapse, il active le changement de pliage et l'activation du prion en plaçant un groupe de phosphates. De là, tant que les agrégats du prion seront maintenus, des souvenirs à long terme seront conservés. Ils sont la base biochimique de la mémoire.

Oui, sa propre responsabilité en tant que système de mémoire transforme les prions en agents pathogènes des neurones et de la mémoire. On pourrait ainsi comprendre leur implication dans les maladies d'Alzheimer et de Parkinson.
Floraison des plantes
Les mammifères ne sont pas les seuls à profiter du travail des prions. Par exemple, les génétiques du Massachusetts Institute of Technology (MIT) ont trouvé dans les plantes environ 500 protéines avec des caractéristiques de prions. Beaucoup d'entre eux ont des fonctions liées à la réalisation.
Les plantes développent la mémoire pour répondre aux conditions de l'environnement. Ils enregistrent des sécheresses, des échauffements, des refroidissements et des agents pathogènes précédemment atteints. La mémoire de l'hibernation, par exemple, se développe après avoir senti le froid pendant longtemps. Grâce à cette mémoire, les plantes rappellent les hivers qui sont passés et régulent le moment de la floraison. Selon les chercheurs du MIT, les prions sont essentiels pour enregistrer à long terme les conditions de l'environnement et réguler le processus de floraison des futurs. En quelque sorte, dans la descendance ils aident aussi à conserver la mémoire du froid, de génération en génération, sans devoir impliquer les gènes. Grâce à eux, les plantes qui n'ont pas encore souffert froid ont cette mémoire. Selon les chercheurs du MIT, les prions ont fourni la clé pour comprendre la mémoire moléculaire basée sur des protéines.
Aussi les bactéries
Jusqu'à présent, les bactéries étaient les seules qui n'ont pas montré de signes de prions parmi les êtres vivants, mais les dernières études ont montré que les bactéries aussi les ont. 60.000 génomes bactériens ont été analysés à la recherche de séquences génétiques similaires aux prions des levures et ont vu qu'une séquence de protéines appelée Rho pouvait être un bon candidat. Ainsi, il a été prouvé que la protéine Rho de la bactérie Clostridium bolutilum est injecté dans la bactérie Escherichia coli et se comporte comme les prions.
Le Rho est un composant qui régule l'expression et l'activité de nombreux gènes. En injectant la version normale de la protéine Rho, ils ont vu qu'il réduisait l'activité génétique d'Escherichia coli et qu'en injectant la version prionique beaucoup de gènes étaient activés. À cet égard, les chercheurs croient que dans le cas des bactéries, en régulant les gènes, les prions peuvent aider à s'adapter aux changements brusques des conditions environnementales. Cela permettrait de donner une réponse rapide aux changements de conditions, comme la présence d'un antibiotique.
En outre, étant donné que les prions sont héréditaires, il est à penser qu'ils permettront aux bactéries d'hériter de ces caractéristiques sans mutations génétiques.
En raison de leur présence dans les bactéries, les prions semblent être beaucoup plus étendus dans la nature que ce qu'on pensait, et ils sont apparus avant l'apparition des eucariotes, il y a plus de 2,3 milliards d'années. Mais d'où viennent ces mystérieuses protéines ?
Les prions n'ont jamais été ceux qui passent inaperçus. Ils sont habitués à donner des surprises. Cependant, nous ne savons pas ce que les autres capacités vont leur donner leur caractère spécial. Les chercheurs affirment qu'ils ont déjà commencé à les comprendre et qu'ils apporteront presque nécessairement plus de surprises.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia