Destino: motores moleculares
2010/03/01 Lakar Iraizoz, Oihane - Elhuyar Zientzia Iturria: Elhuyar aldizkaria

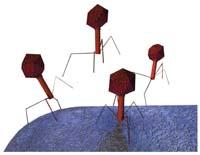
El ADN del virus empieza a dar órdenes cuando entra en una célula hostal y pone a su disposición la maquinaria de la célula. Por lo tanto, los virus sólo necesitan ADN para avanzar. Tira, ADN y una tapa o capside para protegerla.
Las células hosteleras, por un lado, realizan varias copias de este ADN del virus y, por otro, de la cápsida. El ADN entra en el interior de la cápsida en un siguiente paso, y es entonces cuando los nuevos virus están dispuestos a salir de esta célula y atacar a otros. "En media hora de un virus se producen ochenta virus", explica Carlos Bustamante, biofísico de la Universidad de California.
En concreto, Bustamante habla del virus phi-29, que desde hace diez años están investigando en su laboratorio. El pasado otoño, Atom by Atom visitó San Sebastián, donde expuso sus investigaciones sobre este virus.
El virus Phi-29 es un virus que ataca a las bacterias, pero su comportamiento se parece mucho a otros virus que nos afectan a los seres humanos como la poliomelitis, el herpes o la varicela. Por lo tanto, los mecanismos que observan en uno y las estrategias de prevención de la enfermedad pueden servir, probablemente, para otros.
El motor como destino
En este caso, los investigadores se han centrado en el mecanismo que ensamblan el virus, es decir, el mecanismo que introduce el ADN dentro de la cápsida, en el que intervienen unos pequeños motores moleculares, unas pequeñas máquinas a escala nano, que dan ese paso imprescindible para la formación del virus.
"Si conseguimos eliminar estos motores, evitaríamos que se formaran virus", explica Bustamante. De esta manera se podrían combatir de forma radical las infecciones de los virus. Pero para llegar a este objetivo es conveniente conocer al máximo el motor.

Según explica Bustamante, para meter el ADN del virus en la cápsida, "el motor tiene que hacer un gran trabajo". De hecho, el ADN debe compactar seis mil veces su volumen en libertad. "Demasiados espaguetis para una cabeza tan pequeña", afirma.
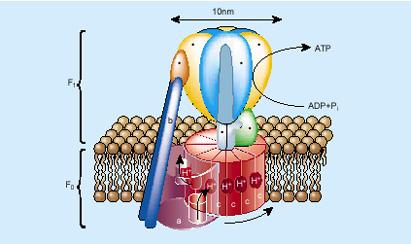
El motor tiene forma anular para que desde el hueco central se vaya introduciendo el ADN en la capsa. Se trata de un motor formado por varios grupos de proteínas y enzimas, entre los que se encuentra el núcleo de todo este trabajo o, como ha dicho Bustamante, "los verdaderos pistones de este motor". Se trata de un conjunto de cinco ATPasas. Las ATPasas son capaces de romper un determinado enlace de las moléculas de ATP; al romperlas, se libera energía y con esta energía, las ATPas modifican la conformación. Es decir, los ATPs convierten la energía química en energía mecánica, al igual que los pistones de los motores convencionales.
En este cambio de conformado, las ATPasas se contraen hacia el interior de la cápsida y con este movimiento el motor lo introduce en la capsa ADN.
Goliat frente a frente
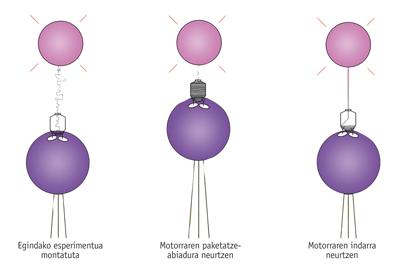
Al conocer su funcionamiento, Bustamante y sus compañeros quisieron ir más allá y conocer sus "especificaciones técnicas". Es decir, querían saber qué fuerza tiene, a qué velocidad mete el ADN dentro de la cápsida, etc. Para ello actuaron de alguna manera en la "sokatira" con el virus, es decir, cogieron la cápsida y el ADN por los dos extremos y midieron las fuerzas.
Como media se observó que el virus introduce 100 pares de bases por segundo en la cápsida. Sin embargo, la velocidad disminuye a medida que el ADN se acumula en la cápsida, debido a la creciente presión interna de la misma.
Al ir disminuyendo la velocidad, vieron que la fuerza necesaria para realizar este trabajo es cada vez mayor. Como describió Bustamante, "este motor es equivalente al Goliat entre los motores moleculares, el motor más potente jamás medido". De hecho, cuando tiene la mayor parte del ADN en su interior, es decir, cuando tiene que hacer la mayor fuerza, el motor puede llegar a hacer una fuerza del piconewton 57-60. "Es una fuerza enorme", afirma Bustamante, y la comparó con la capacidad de otros motores moleculares. "Por ejemplo, la miosina que permite la contracción de nuestros músculos también tiene ATPasas, pero cada una de ellas sólo puede ejercer una fuerza de cinco piconewtons".
Con tanta fuerza el ADN se acumula en la cápsida a 60 atmósferas. Por ejemplo, el champán se encuentra a 5-6 atmósferas de presión en las botellas.
Por supuesto, para hacer todas estas fuerzas, los virus deben dilapidar un montón de energía; "si la cápsida tuviera un doble tamaño, por ejemplo, ahorrarían mucha energía", explica Bustamante. Pero "el objetivo del virus no es ahorrar energía", dice. En definitiva, esta energía que utiliza el motor no debe ser generada por el virus, es propiedad de la célula huésped, por lo que "no le importa derrochar energía".
Y además, todo esto es útil para el virus. Los nuevos virus, al salir de la célula huésped, pasan a un medio sin ATP: el intercelular. Allí no tienen acceso a la energía, y es entonces cuando aprovechan toda la energía disipada en la célula huésped: cuando llegan a otra célula hostelera le inyectan el ADN que tienen almacenado a una presión de 60 atmósferas. "Esta energía potencial se transforma en energía cinética e introduce bajo presión el ADN en la nueva célula hostelera", explica Bustamante. En su opinión, "es una estrategia muy elegante".
Contra los virus y más
Conocidos todos estos detalles del motor molecular, es evidente que una estrategia anti-virus muy eficaz podría conseguirse al llegar a eliminar los motores moleculares.
"Pero para ello no basta con estudiar la mecánica de los motores moleculares", explica Itziar Alkorta, profesora del Departamento de Bioquímica y Biología Molecular de la UPV. "Sin duda es importante la investigación que han realizado, pero si se quiere diseñar un medicamento para eliminar este grupo de proteínas, es necesario realizar también estudios bioquímicos para conocer las características de las proteínas y poder así elegir compuestos que puedan combatirlas", ha añadido Alkorta.
Precisamente, Alkorta realiza estudios bioquímicos con otro motor molecular. Este motor no está asociado a virus sino a bacterias. "Estamos investigando un motor molecular que participa en la conjugación de bacterias". El objetivo final de este grupo de investigadores es llegar a eliminar la conjugación, entre otras cosas porque la resistencia a los antibióticos se propaga a través de la conjugación. La conjugación es el intercambio de ADN observado en las bacterias, a través del cual las bacterias comparten mucha información.

Una vez que dispongan de toda la información necesaria y conozcan en detalle todos los aspectos que deben conocerse sobre los motores moleculares, será más fácil desarrollar medicamentos contra los motores. "Lo más difícil es conocer la maquinaria de un sistema concreto, es decir, cómo funciona a nivel molecular", explica César Martín, otro miembro del mismo departamento de la UPV. Después, con esta información, es "fácil" buscar vías para eliminar el sistema. Alkorta comparte esta opinión: "No es algo que se consigue de un día para otro, pero no es una tarea difícil".
Pero aunque no es difícil, es algo que hay que controlar con mucho cuidado. De hecho, "el intento de frenar el motor del virus también podría correr el riesgo de detener los motores de las células sanas", ha destacado Alexander Bittner, jefe del grupo de autoensamblajes de CIC nanoGUNE.
Además de actuar contra ellos, el conocimiento exhaustivo de los mecanismos de los motores moleculares puede permitir idear herramientas biotecnológicas a escala nano por imitación. En definitiva, en todos los procesos celulares relacionados con el movimiento, como el movimiento de los flagelos, la duplicación celular y la contracción muscular, está involucrado algún motor molecular. Por lo tanto, podremos imitar cualquier sistema de este tipo cuando aprendamos a imitar o manipular motores, y seremos capaces de proveer de motores que hagan móviles a células inmóviles o máquinas de escala nano.
Por ejemplo, se podrán utilizar para terapias génicas. "Las terapias génicas consisten básicamente en introducir un trozo de ADN en determinadas células para evitar un proceso que se está produciendo en la célula gracias a este ADN o, por el contrario, para impulsar algo que no está ocurriendo". En muchas ocasiones se utilizan virus modificados como vectores para introducir el ADN dentro de las células. Pero sería mucho más eficaz que sólo pudiéramos utilizar motores moleculares, ya que seríamos capaces de bombear el ADN directamente al interior de las células.
Sin embargo, estos objetivos o aplicaciones todavía están demasiado lejos. "Yo me gusta tener los pies en el suelo, y eso está en el futuro; hoy no se ha conseguido hacer eso, que yo sepa", dice Alkorta. No obstante, destaca que no es poco: "Antes o después, conseguiremos trabajar con este tipo de sistemas. Vamos en el camino".

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia