Les prairies traversent les frontières entre les espèces
2001/03/09 Galarraga Aiestaran, Ana - Elhuyar Zientzia

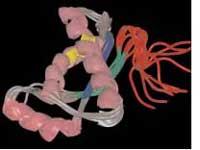
Les protéines responsables de l'ESB sont une variante anormale des prions normaux. En quelque sorte, ils peuvent changer l'apparence des prions normaux et, au fil du temps, tous les prions du cerveau de l'animal ont un aspect pathogène. La maladie est la conséquence de la prolifération des variantes pathogènes de prions ou de la diminution des protéines saines.
Cependant, le plus grand souci des chercheurs est de savoir comment les prions ont fait le saut d'une espèce à l'autre. Certains considèrent que les prions pathogènes sont si souples qu'ils peuvent prendre différentes formes selon l'espèce, l'une pour produire la maladie dans son espèce d'origine et l'autre pour une seconde. Une autre théorie dit que vous avez besoin d'un autre agent, par exemple, d'une autre protéine qui n'est pas encore connue.
La recherche de réponses à ces questions chez les mammifères est très difficile, car la production de prions pathogènes de mammifères dans le laboratoire n'a pas été atteinte et les échantillons de tissus infectés contiennent d'autres substances en plus des prions. C'est pourquoi Peter Chien et Jonathan Weissman, de l'Université de Californie, ont utilisé deux espèces de levures (Candida albicans et Saccharomyces cerevisae) pour étudier le saut entre espèces. En fait, travailler avec des levures est techniquement beaucoup plus simple, économique et rapide.
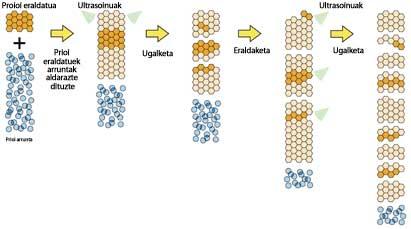
Les cellules de levure produisent un prion appelé sup35 qui, comme la plupart des prions de mammifères, ne peut pas être affecté par le sup35 normal d'une autre sorte de levure. Les chercheurs voulaient savoir à quel point les prions des deux espèces devraient ressembler pour que le prion d'une espèce puisse affecter une autre. Pour cela, en collant les morceaux de prion des deux levures, ils ont créé le prion chimérique, qui n'est pas dans la nature.
Selon eux, seule une fin des prions pathogènes permettait de connaître les prions normaux et de modifier leur apparence. On espérait donc que le prion chimérique n'affecterait qu'une des deux espèces. Cependant, la chimère a réussi à faire apparaître les supprions des deux espèces de levure comme des bourgeons.
Cette étude montre que les prions peuvent prendre différentes formes pathogènes et peut influencer d'autres protéines. En outre, il n'a pas besoin d'aide d'autres protéines.
Vous devez maintenant tester chez les mammifères pour vérifier que ce qui est observé dans les levures se produit également chez les mammifères. En fait, bien que cette étude soit très importante, les protéines des mammifères sont très différentes.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia