Immunologia del Càncer
1989/10/01 Otsoa Garai, Jorge Iturria: Elhuyar aldizkaria
La irradiació, per exemple, mata les cèl·lules que es reprodueixen ràpidament. Desgraciadament, destrueix tant cèl·lules canceroses com cèl·lules sanes de creixement lleuger (de medul·la òssia, epitelials). Els
fàrmacs, a més d'eliminar les cèl·lules cancerígenes, produeixen accions indesitjades com la immunosupressió. En conseqüència, en els pacients inmunoeliminados (malalts sense sistemes de defensa) el risc d'infecció augmenta considerablement. La
cirurgia, finalment, no és tan fina com les altres, per la qual cosa és molt limitada en els càncers dispersos i en els localitzats en.
La Immunoteràpia és la cura anticanceral, és a dir, la teràpia que el metge realitza amb el Sistema Immune. La immunoteràpia es caracteritza per la seva especificitat i efectivitat. En ser específic, el Sistema Immune actua exclusivament contra les cèl·lules cancerígenes (i no contra les sanes). Per la seva eficàcia destrueix completament el càncer.
No obstant això, a mesura que s'investiga en profunditat el propi Sistema Immune i la seva capacitat per a combatre el càncer, ens hem adonat de la seva reduïda complexitat i efectivitat. A més, a vegades les cèl·lules immunes duen a terme accions oposades que afavoreixen el creixement del càncer.
No obstant això, en molts casos les cèl·lules immunes són capaces de combatre el càncer en general. El coneixement exhaustiu i minuciós d'aquesta complexitat ens ajudarà a aconseguir una teràpia específica i efectiva. Com? Mitjançant la promoció del propi Sistema Immune o la unió de dos tractaments diferents.
Teoria de la Inmunovigilancia
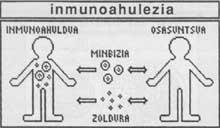
Encara que la principal funció del Sistema Immune és la defensa contra les infeccions produïdes per microorganismes, té una altra funció tan important com és la lluita contra el càncer.
La teoria de la inmunovigilancia explica el mecanisme d'acció del Sistema Immune per a combatre el càncer. Segons aquesta teoria, les cèl·lules cancerígenes apareixen espontàniament i contínuament al llarg de tot el nostre cos. No obstant això, la majoria d'aquestes cèl·lules no evolucionen a càncer desenvolupat o madur, ja que quan apareixen, el Sistema Immune les mata. Les cèl·lules immunes veuen estranyes a les cèl·lules cancerígenes recentment creades a través dels seus antígens superficials i a continuació comencen a destruir-les.
Això ocorre en les primeres fases del desenvolupament del càncer, quan són molt poques les cèl·lules que el formen. Per això, només es produeixen càncer en dos casos: Quan el Sistema Immune està feble (aquesta situació es coneix com inmunodebilidad) o el creixement del càncer és menor que la capacitat de destrucció de les cèl·lules immunes.
Malgrat el seu atractiu, aquesta teoria té evidències tant contràries com favorables.
Evidències Adverses

* D'aquesta teoria pot derivar-se que els éssers humans sense cèl·lules immunes haurien de suportar un nombre de càncers més elevat que els sans, ja que no hi hauria qui mati a les cèl·lules cancerígenes recentment creades.
Hi ha ratolins anomenats “nude” que des del naixement no són limfòcits T. Els limfòcits T constitueixen una de les branques més importants del Sistema Immune. No obstant això, els ratolins “nude” no tenen major percentatge de càncer que els ratolins normals.
* Si a un ratolí se li injecta un nombre suficient de cèl·lules extretes d'un altre ratolí cancerós, aquest –receptor– les rebutja. Aquesta evidència coincideix amb la teoria de la inmunovigilancia.
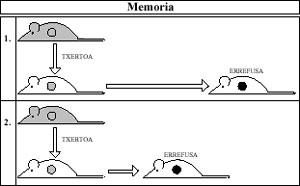
No obstant això, si la dosi injectada és molt petita, el receptor no és capaç de rebutjar i finalment les cèl·lules cancerígenes maten el ratolí. Aquest fet es coneix com “sneaking through” i consisteix en el fet que les cèl·lules injectades són tan poques que el Sistema Immune del receptor no les detecta inicialment. I el càncer està molt desenvolupat per a quan els detecta.
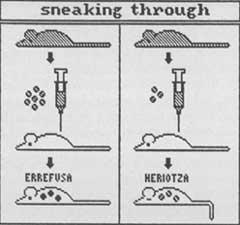
Si la teoria fos certa, és a dir, si el Sistema Immune mata a mesura que es formen cèl·lules cancerígenes, no seria lògic que aquest sistema detectés i destruís més fàcilment les grans quantitats de cèl·lules que les petites.
* Perquè el Sistema Immune pugui atacar i destruir cèl·lules recentment creades cancerígenes, ha d'observar molècules estranyes en la seva superfície. Aquestes molècules són antigèniques, és a dir, capaces de produir resposta immune. Si no hi ha antígens estranys de superfície no es realitza resposta.
No obstant això, la majoria dels càncers naturals que apareixen en l'ésser humà no contenen molècules estranyes de la pell. I en tot cas, aquestes molècules no són capaces (per diverses causes) de produir una resposta immune.
Quina és la raó? Com ja s'ha esmentat, les cèl·lules que formen el Sistema Immune només maten a les cèl·lules antígenas. Per tant, les úniques cèl·lules cancerígenes que sobreviuen són antígenas, que són els que es converteixen en càncer desenvolupat.
La capacitat d'aquestes cèl·lules cancerígenes per a evitar el Sistema Immune és el que es denomina fuita immunològica.
Evidències favorables
* En contra del que ocorre en el ratolí “Nude”, els pacients amb la funció de limfòcits T afeblida tenen majors possibilitats de sofrir càncer que les persones sanes. Això significa que el Sistema Immune exerceix un cert paper contra el càncer en els éssers humans.
Un clar exemple és la SIDA. Aquests pacients tenen afeblida la funció dels limfòcits T, alhora que presenten una incidència de càncer bastant alta com el sarcoma de Kaposi.
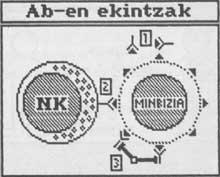
* Hi ha ratolins anomenats “beix” sense cèl·lules NK. Les cèl·lules NK constitueixen una important branca del Sistema Immune contra el càncer.
Els ratolins són més propensos al càncer que els ratolins convencionals. Aquesta evidència afavoreix la teoria de la inmunovigilancia.
* El principal problema que es planteja després del trasplantament és, lògicament, el rebuig. El rebuig és realitzat per les cèl·lules immunes (limfòcits T, principalment) del receptor. Aquestes cèl·lules destrueixen el teixit inserit després d'haver-lo vist estrany.
Una via per a evitar el rebuig (o almenys per a reduir el risc de rebuig) és l'administració al pacient de fàrmacs que eliminen la funció de cèl·lules immunes. Aquestes cèl·lules no sols participen en el rebuig del trasplantament, sinó que també actuen contra els càncers i les infeccions, per la qual cosa el malalt inmunogutxado queda desprotegit.
Per tant, els pacients que reben el nou òrgan i prenen fàrmacs inmunosupresores per a evitar el rebuig presenten una major inferència de càncer que la gent normal. Això subratlla la importància del Sistema Immune enfront del càncer.
Cèl·lules immunes al càncer
A pesar que la teoria de la inmunovigilancia continua sent una interrogació sense resposta, sabem que el Sistema Immune és capaç de fer front a certs tipus de càncer, tant en els seus inicis com en posteriors ocasions.
a) Immunitat específica
Realitzat pels limfòcits T i B. Totes dues cèl·lules necessiten ser prèviament sensibles, és a dir, un contacte previ amb l'antigen cancerigen per a poder generar resposta immune. Les dues cèl·lules, per part seva, han de conèixer l'antigen cancerigen juntament amb les molècules histocompatibles. Si aquestes molècules són estranyes, és a dir, si la cèl·lula cancerosa no és considerada com a pròpia, les cèl·lules immunes esmentades no són capaces de matar o destruir el càncer.
El limfòcit B, després de conèixer l'antigen de la cèl·lula cancerígena (després del contacte), es converteix en una cèl·lula plasmàtica que produeix i segrega anticossos. Aquests anticossos són capaços d'associar-se especialment a l'antigen cancerigen i a través d'aquesta capacitat participen en accions contra el càncer:
- s'adhereixen a les cèl·lules de macrofago i/o NK i realitzen citotoxicitat per Ab. En aquesta mena de citosis l'anticòs diu quina és la cèl·lula diana, és a dir, quina és la cèl·lula que ha de morir. La cèl·lula de macrofago o NK només fa la ciólisis.
- s'afegeixen als antígens cancerígens de la superfície de la cèl·lula cancerígena, que són un lloc privilegiat per a les molècules del complement. El complement són unes proteïnes solubles en plasma. Quan aquestes proteïnes s'uneixen als antígens de la pell de la fita s'exciten i per efecte de l'excitació perforen la membrana de la cèl·lula en diferents llocs. Això provoca la mort del blanc. A aquesta mena de citosis se'n diu citosis amb complement.
- s'uneixen i eliminen als antígens cancerígens que segreguen les cèl·lules cancerígenes presents en els fluids corporals. Per tant, els anticossos eviten que els antígens cancerígens satisfacin als receptors dels limfòcits T i, en conseqüència, perdin la funció d'aquestes cèl·lules.
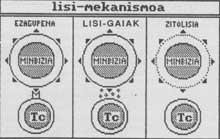
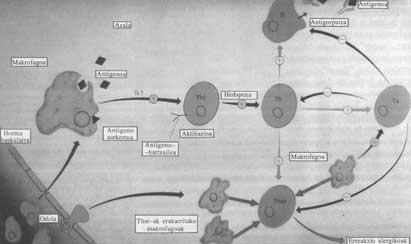
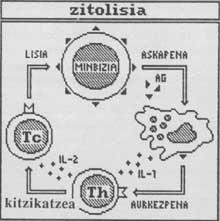
Els limfòcits T destrueixen el càncer per accions de citotoxicitat o citosis. En aquestes accions es coordinen i comuniquen els macròfags d'una banda i l'auxiliar de població i citotòxic dels limfòcits T per un altre mitjançant molècules solubles.
En el primer pas la cèl·lula cancerígena segrega a l'exterior antígens cancerígens. Alguns d'aquests antígens són captats per macròfags sobre la membrana, uns altres són capturats pel citotòxic T en receptors superficials.
En el segon pas, el macròfag presenta antígens de càncer sobre membrana a l'ajudant T i flueix interleucina 1 (IL-1). La presentació de l'antigen excita a l'assistent T i fa que les secrecions d'interleucina augmentin i madurin. Les interleucines són factors solubles produïts i segregats per les cèl·lules del Sistema Immune. Tenen la funció d'interactuar entre cèl·lules immunes, tant excitants com inhibidors.
L'ajudant T és, per tant, excitat pels coneixements de l'antigen cancerigen i obligat a créixer i créixer per IL-1. A continuació, en el tercer pas, l'auxiliar T segrega la interleucina 2 (IL-2) que excita al citotòxic T. Com s'ha esmentat anteriorment, el citotòxic T conté antígens cancerígens en els receptors.
Finalment, en el quart pas, el citotòxic T realitza una acció citolítica contra les cèl·lules cancerígenes que posseeixen antigen cancerigen cancerigen en la superfície. El mecanisme de ciólisis consta de tres fases:
- T citotòxica coneix la cèl·lula diana (en aquest cas la cèl·lula cancerosa).
- La T citotòxica segrega substàncies citoolíticas.
- els temes citolíticos allisen o maten la cèl·lula diana.
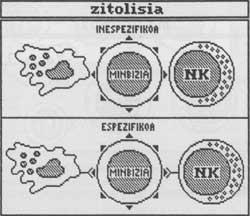
b) Immunitat inespecífica
Compost principalment per cèl·lules NK i macròfags. Aquestes cèl·lules no requereixen de predictibilitat, és a dir, són capaces de produir una resposta immune sense contacte previ amb l'antigen cancerigen. D'altra banda, i a diferència de la immunitat específica, no és necessari que les seves mateixes molècules histocompatibles es vegin en la cèl·lula per a poder iniciar la ciólisis. Poden matar cèl·lules pròpies o estranyes. No obstant això, només actuen contra cèl·lules anormals (com les de càncer). Això significa que coneixen un antigen que està present sobre les membranes de cèl·lules canceroses i atrevit a la cèl·lula més sana. El mecanisme d'acció és similar a les cèl·lules T de la branca específica.
No obstant això, si els anticossos produïts pels limfòcits B s'adhereixen a la pell, actuen com a cèl·lules específiques i només actuen contra l'antigen cancerigen que va provocar la producció d'aquests anticossos.
Al marge de la destrucció de càncer, les cèl·lules NK tenen la capacitat d'impedir el desenvolupament de metàstasi. Tenim nous focus que alliberen les metàstasis del càncer d'origen i es dispersen a través dels vasos sanguinis o limfàtics a diferents punts del cos. Encara que en els seus inicis es tracta de petits grups cel·lulars, aquests focus evolucionen a través del temps cap a un càncer desenvolupat.
D'altra banda, les cèl·lules NK poden ser excitades per IL-2, convertint-se en cèl·lules LC. Les cèl·lules LC tenen una acció de chit intensa.

Per part seva, els macròfags, a més de la seva funció citotòxica directa contra les cèl·lules cancerígenes, tenen un efecte citostàtic, és a dir, interrompen o frenen la proliferació de cèl·lules canceroses.
D'altra banda, com ja s'ha indicat, ensenya a l'ajudant T l'antigen cancerigen, que exerceix un deure inexcusable en l'acció citotòxica dels limfòcits.
Existeixen relacions intestinals entre la immunitat específica i inespecífica, sent la resposta immune al càncer una interacció coordinada entre totes dues branques.
Els auxiliars LT, com les LT citotòxiques, així com les cèl·lules NK, o els macròfags, produeixen i segreguen substàncies anomenades linfoquinas (les interleucas a dalt descrites són només un tipus de linfocina).
Així mateix, els anticossos creats pels limfòcits B "armen" les cèl·lules NK o macròfags contra l'antigen específic.
Per part seva, els macròfags presenten a l'auxiliar LT els antígens alliberats pel càncer.
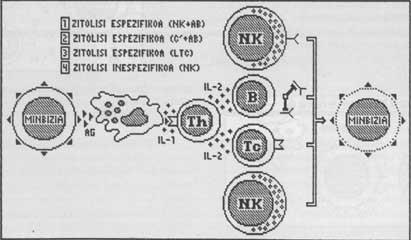
Fuita Immunològica
A pesar que el Sistema Immune ataca eficaçment a éssers estranys (microorganismes, cèl·lules cancerígenes, cèl·lules vacunades), certs càncers eviten l'agressió de cèl·lules immunes per mecanismes “maliciosos”. La capacitat d'extinció dels atacs es diu fuita immunològica.
En general, el càncer fuig quan els factors que afavoreixen el seu creixement són més forts (més importants) que els de la destrucció que realitza el Sistema Immune.
Alguns d'aquests mecanismes només eviten la resposta immune normal o fisiològica. Uns altres, per contra, també apaguen la immunoteràpia que imposa el metge.

Els més importants són:
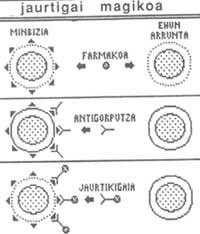
- Camuflatge (“sneaking through”): El Sistema Immune detecta i destrueix ràpidament grans quantitats de cèl·lules amb càncer. Per contra, les quantitats petites es camuflen fàcilment i eviten la resposta immune. Més tard aquests últims poden convertir-se en càncer desenvolupat. (Veure figura 1).
- Emmascarament: està format per una capa que recobreix antígens cancerígens per cèl·lules cancerígenes (constituïda per la sialomucina o substàncies similars). Al no poder entrar en contacte amb antígens de càncer de cèl·lules cancerígenes, les cèl·lules immunes no poden ser considerades estranyes i no es realitzen respostes.
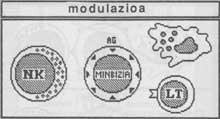
- Modulació: algunes cèl·lules cancerígenes amb antígens en la pell interioritzen aquests antígens en la presència de cèl·lules immunes. Gràcies a aquesta capacitat, el càncer no es considera un càncer ni s'agredeix.
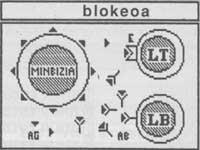
- Bloqueig: les cèl·lules cancerígenes alliberen gran quantitat d'antígens superficials al medi ambient. Aquests antígens s'associen als anticossos produïts pels limfòcits B i als receptors dels limfòcits T, bloquejant tots dos. Així, les cèl·lules cancerígenes se sotmeten a les dues branques del Sistema Immune específic: l'humoral (anticossos) i el cel·lular (limfòcits T).
- Inhibició: algunes cèl·lules cancerígenes segreguen substàncies que inhibeixen o alteren d'alguna manera la resposta immune (com les prostaglandines). Aquestes substàncies afecten les cèl·lules immunes. Per tant, realitzen acció antiinmune.
- Eliminació: existeix una població de limfòcits T (denominats eliminadors T) que elimina l'activitat del Sistema Immune. Tenen l'obligació original de governar la resposta immune per a evitar l'excés de funció immune, és a dir, aconseguir un equilibri entre la intensitat del ser estrany i la resposta. Però en eliminar o reduir l'acció de les cèl·lules immunes eliminen el mur que dificulta el creixement del càncer i afavoreixen el desenvolupament del càncer.
Immunoteràpia
Els objectius generals de la immunoteràpia són augmentar la resistència al càncer del pacient i disminuir les possibilitats de fugida de les cèl·lules cancerígenes.
Existeixen diferents tipus d'immunoteràpia:
* Immunització activa específica: activa pel compliment de la necessitat activa per part del Sistema Immune del pacient. És específic perquè el malalt s'immunitza especialment contra la mena de càncer que s'utilitza en la immunització (i no contra qualsevol altre).
En realitat es tracta d'una immunització contra l'antigen cancerigen que consisteix en la injecció al pacient d'antigen cancerigen extret de cèl·lules cancerígenes. Això genera defenses contra l'antigen i pot dificultar el creixement del càncer, a més d'estar preparat per a resistir davant l'aparició del propi càncer.
L'inconvenient d'aquesta teràpia és que és gairebé impossible predir quin tipus de càncer suporta el pacient (excepte els busos). I per descomptat, la immunització no és molt efectiva si el càncer està introduït, ja que el Sistema Immune necessita temps abans de començar a treballar (temps de sensibilització).
* Immunització activa inespecífica: és inespecífica perquè el Sistema Immune se sensibilitza no sols contra l'antigen cancerigen, sinó contra qualsevol.
Atès que la resposta és tan àmplia, és a dir, és contrària als antígens tan diversos, és poc intensa contra un d'ells; en alguns casos pot frenar el desenvolupament del càncer però mai destruir-lo.
Les substàncies utilitzades en aquesta mena de terapèutica són BCG, Levamisol i Poli:A Poli:O.
Hi ha altres substàncies solubles, com a interleucines, interferons, factor de necrosi del tumor (TNF) i hormones de l'estafa, específiques a les cèl·lules immunes que exciten al càncer però inespecífiques del càncer. Aquests factors poden barallar per una llarga gamma d'antígens, però la resposta immune la realitzen determinades cèl·lules (excitades pels factors).
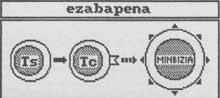
* Immunoteràpia passiva cel·lular: és passiva perquè el Sistema Immune del pacient no treballa. Cel·lular per acció limfocitària.
Consisteix a injectar al pacient tant limfòcits extrets d'una persona sensibilitzada com limfòcits activats en laboratori. Només aquests limfòcits “forans” s'enfronten al càncer.
* Immunoteràpia passiva humoral: es diu humoral perquè al pacient se li injecten humors (molècules dissoltes en líquid).
Les molècules solubles utilitzades en aquest cas són anticossos específics contra el càncer.
* Teràpia inmunocenatoria: consisteix en l'administració al pacient de substàncies inmunosupresoras (com les prostaglandines) o inmunodebilitadoras produïdes pel propi càncer.
* Quimioteràpia corregida: com s'ha esmentat, el principal inconvenient de la quimioteràpia és que els fàrmacs quimioteràpics maten espontàniament a cèl·lules que es reprodueixen ràpidament. Les cèl·lules cancerígenes es dupliquen tan ràpidament que són les cèl·lules més sensibles a aquests fàrmacs. Però aquests fàrmacs ataquen igual a cèl·lules sanes que es reprodueixen ràpidament, com les de la medul·la òssia i les dels epitelis.
D'altra banda, els anticossos són capaços d'adherir-se només al càncer (i no a cèl·lules sanes), però no a la mort cel·lular.
Una manera d'evitar aquests inconvenients és combinar la quimioteràpia amb la immunoteràpia. En associar-se tots dos associem l'eficàcia antiminvital del fàrmac amb l'especificitat del Sistema Immune.
La tècnica consisteix a crear anticossos específics contra el càncer. Peguem en el laboratori un fàrmac amb acció tòxica als anticossos. El complex resultant es diu “projectil màgic”. L'anticòs del complex s'associa a cèl·lules cancerígenes i el fàrmac realitza una acció citotòxica contra elles.
Encara que sembli molt interessant, aquesta teràpia no és tan efectiva a causa de problemes com la feble unió entre l'anticòs i la cèl·lula que es trenca amb facilitat, la irrigació reduïda del centre del càncer i la difícil entrada a la vall de l'anticòs (els anticossos arriben a través dels vasos sanguinis), la modulació més antígena (veure davant), l'heterogeneïtat dels càncers en les diferents cèl·lules antígenas, antígenas, antígenas, antígenas.
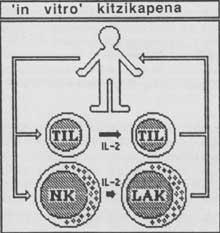
Immunoteràpia adoptiva: extirpació al pacient cancerós de cèl·lules immunes amb activitat antiminvital mitjançant excitació interleucina en el laboratori i reinyección.
Aquesta tècnica consisteix en cèl·lules LC (cèl·lules NK activades pel linfocín) i TIL (limfòcits presents en el càncer). Aquesta tècnica ha obtingut resultats bastant satisfactoris en pacients que han aconseguit erradicar el càncer.
Encara que les vies per a combatre els càncers són molt variades, són molt poques les cancelleres. La causa radica en la gran heterogeneïtat dels càncers, tant en l'òrgan o teixit originari (ja que tots els teixits del cos poden sofrir càncer), com en la mateixa causa (virus, irradiacions, substàncies químiques) i en la mena d'antigen cutani o membranós.
Per tant, en el futur predomina la teràpia adaptada a cadascun d'ells, és a dir, una teràpia especial per a cada tipus de càncer i malaltia, en la qual es barregen i complementen diferents tractaments.
Abreviatures: Ag: antigen (antigen); Ab: anticòs (antibody); Th: Assistent T (helper); Tc: T citototóxica (cytotoxic); IL: interleukina ; c’: complement (dotació); E: Destinatària; Ts: Eliminador T (suppressor); NK: natural killer; LL: lymphokine activated killer; TIL: tumor infiltrating lymphocyte.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia