Visibilitzant l'invisible: microscòpia d'expansió
2022/08/31 Jon Ander Nieto Garai - Biokimika eta Biologia Molekularreko doktoratu osteko ikertzaileaEHU | June Olazar Intxausti - Biokimika eta Biologia Molekularreko doktoradutza aurreko ikertzaileaEHU Iturria: Elhuyar aldizkaria
Com es poden observar les estructures nanoscópicas sense gastar un milió d'euros? Les troballes de microscòpia de punta de punta sempre han estat a l'abast d'uns pocs científics milionaris del moment. Amb la finalitat de contrarestar això, se li va ocórrer a un grup d'individus que, si no podem considerar al microscopi estructures nanoscópicas, per què no augmentar la seva grandària? Neix així el que avui coneixem com espantón-microscòpia.
XIX. Igual que va ocórrer en el segle XX amb la física, avui dia són pocs els descobriments biològics que es poden fer en el món macroscòpic. Han arribat a la seva fi els dies en què l'assajada paleontòloga Mary Anning, amb el seu martell a la mà i guiada per una mera motivació, trobava desenes d'espècies desaparegudes a les platges angleses. Avui dia, per a comprendre els processos biològics que regeixen les nostres vides i realitzar avanços significatius en el camp de la biologia i la medicina, hem d'analitzar organismes, estructures, molècules i processos que no podem veure a simple vista.
L'ésser humà pot distingir objectes de grandària 0,1 mm. Qualsevol grandària és considerada com a microscòpic i no és visible a simple vista. Per a això necessitem instruments que ens ajudin a augmentar la imatge del que volem observar, els microscopis.
Microscopi òptic XVII. Va començar a utilitzar-se a Europa en el segle XX, la qual cosa va permetre superar la barrera macroscòpica i penetrar en el món microscòpic. Els primers microscopis òptics van permetre localitzar protozous, bacteris i altres microorganismes desconeguts, canviant completament el paradigma de l'època. Però com ocorre amb molts descobriments científics, el microscopi òptic va portar amb si més preguntes que respostes, ja que en el món microscòpic molts organismes no tenen color, són transparents, per la qual cosa van haver de dissenyar mètodes de tenyit per a poder observar-los.
De la mateixa manera, encara que aquestes tintures permetien separar un teixit, cèl·lula o orgànuls d'un altre, no aportaven molta informació quant al nivell molecular. Per tant, com avanç de les tintes inicials, XX. en la segona dècada del segle XX es va desenvolupar la primera fluorescència -microscopi. Aquest tipus de microscopi utilitza la llum emesa per les molècules fluorescents per a observar els detalls de la mostra.
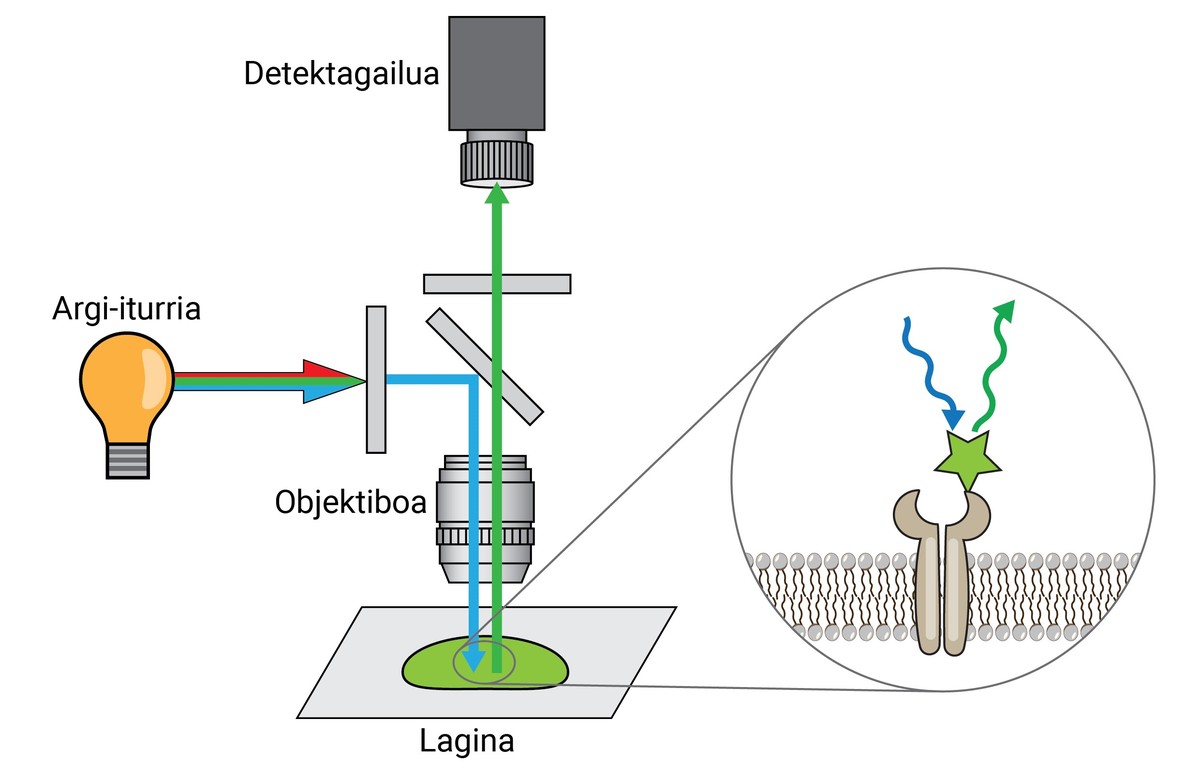
Un microscopi de fluorescència punta pot separar dues molècules o estructures a una distància igual o superior a 250 nm, amb una resolució 400 vegades major que la de l'ull humà. Això es diu limiti de resolección i és una de les característiques més importants d'un microscopi.
Aquest límit de 250 nm no és suficient per a separar molècules individuals, per la qual cosa en la dècada de 1990 es va desenvolupar una microscòpia de superresolución la resolució de la qual aconsegueix els 25 nm [1]. Recentment s'ha aconseguit reduir aquest límit fins a 3 nm amb la tècnica de superresolución MINFLUX [2]. Aquesta tècnica permet diferenciar estructures a una distància de 3 nm, és a dir, estructures 25.000 vegades més petites que un pèl humà, com a molècules úniques.
Com es pot observar, en la història de la microscòpia cada vegada que es trenca una barrera apareix una altra. En molts casos, aquestes barreres han estat tècniques (com aconseguir una major resolució?). ), però, per exemple, si s'arriba al límit de resolució d'una sola molècula amb la tècnica MINFLUX, la barrera que s'ha trobat és una altra: la barrera econòmica. Desafortunadament, en augmentar la resolució també augmenta el cost dels microscopis de superresolución. En general, requereixen d'infraestructures molt costoses i programari sofisticat que només estan a la disposició d'uns pocs laboratoris. Per exemple, un nou microscopi MINFLUX costa 2 milions d'euros.
La majoria dels laboratoris, per tant, no poden superar aquesta última barrera i han de conformar-se amb microscopis convencionals de fluorescència. No obstant això, en 2015, un equip de recerca va trobar la manera d'estendre la nanoscopia a aquests laboratoris, abordant el problema des d'un altre punt de vista: si el meu microscopi no té suficient capacitat per a diferenciar l'estructura que vull veure, per què no augmentar-la? Neix així l'expurgo-microscòpia [3].
Microscòpia d'expansió
La premissa de la microscòpia espacial sembla conceptualment bastant senzilla. Però tècnicament és complex. En una tècnica microscòpica tradicional, la mostra es marca amb molècules fluorescents per a observar les estructures d'interès, però en la resta es manté la mostra, per la qual cosa manté la seva forma i grandària original. En la microscòpia d'espantsé, per a separar estructures molt petites, s'estén la mostra en tres dimensions fins a aconseguir la grandària suficient per a ser observada amb un microscopi de fluorescència convencional [4].
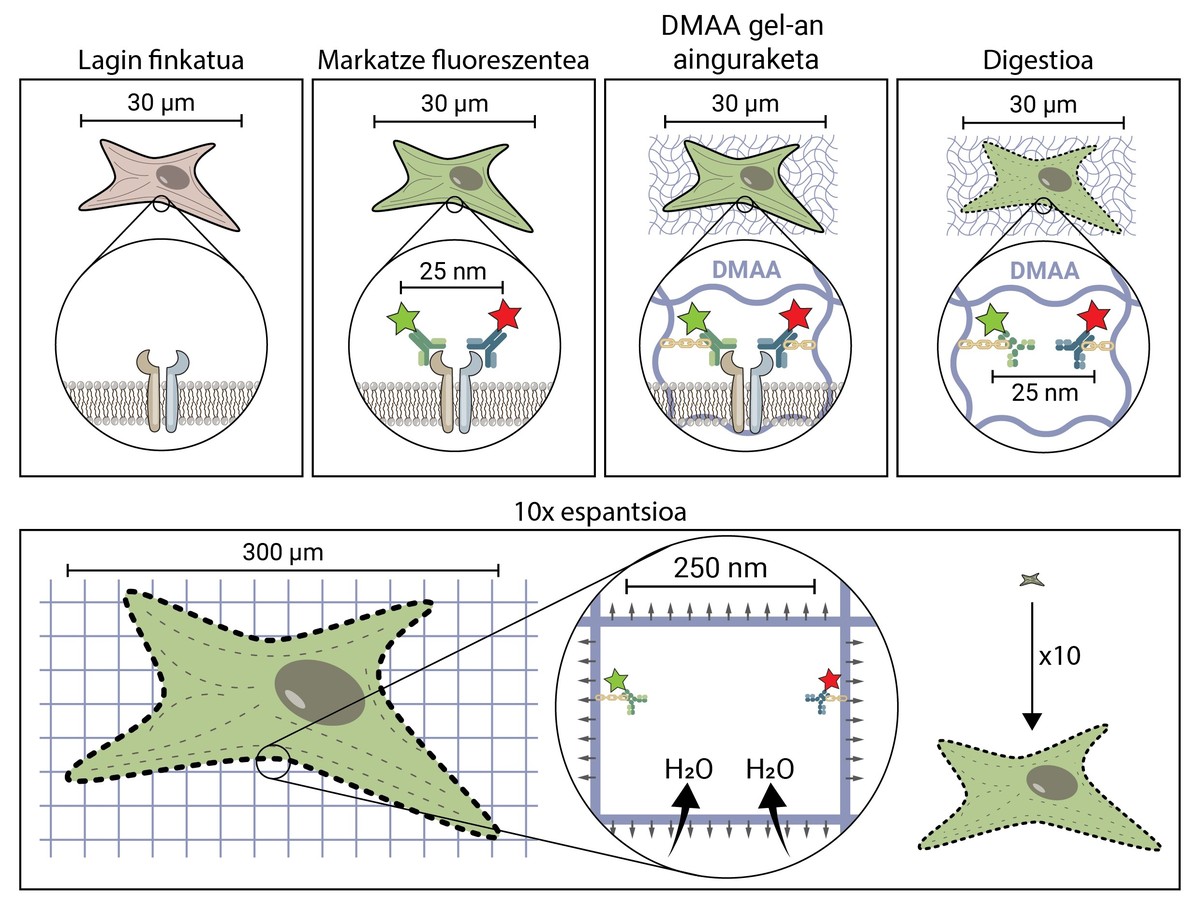
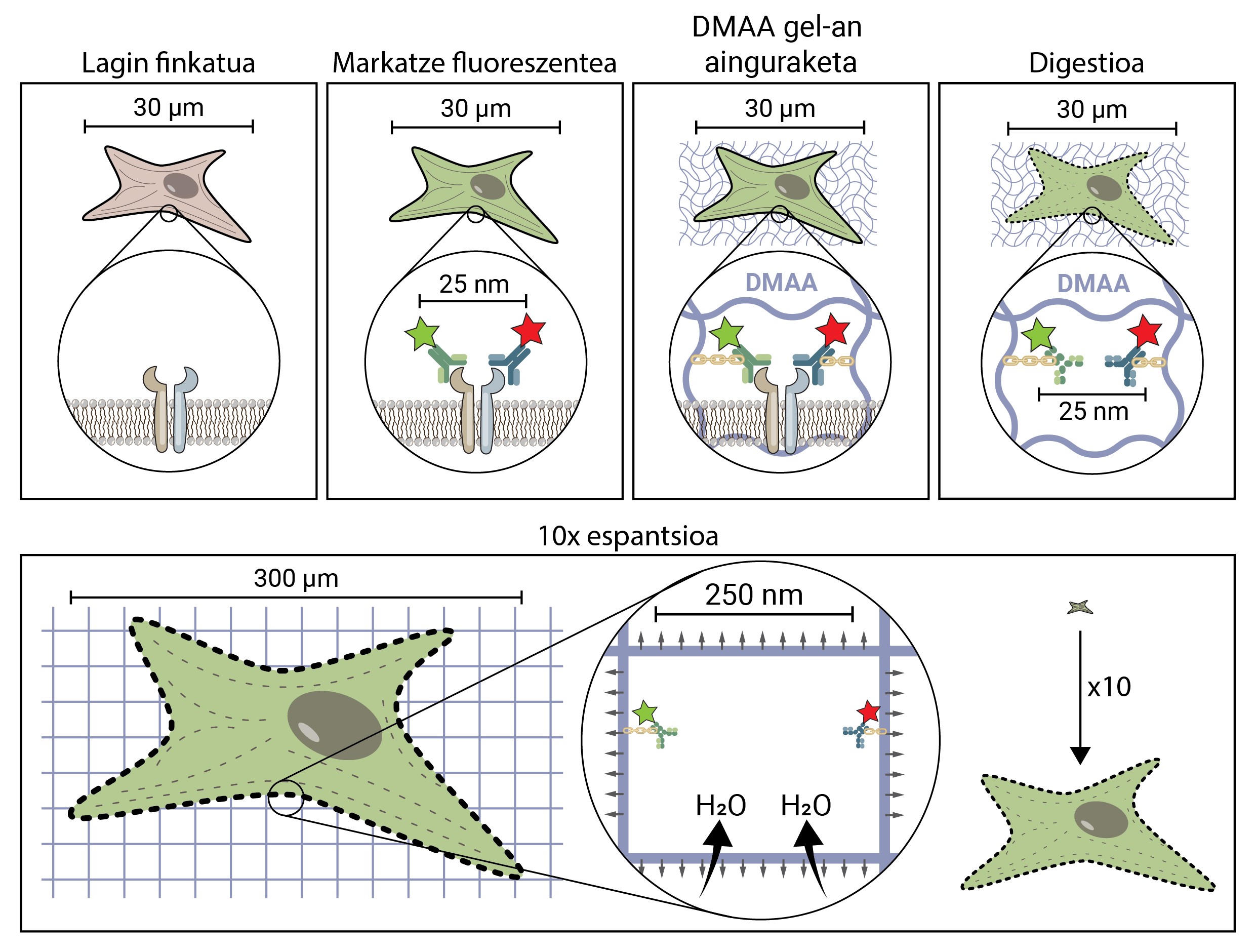
Però, com es propaga una mostra biològica, una cèl·lula, fins a arribar a ser 10 vegades major que la grandària original? El secret està en els bolquers. Els bolquers tenen un gel que absorbeix el líquid en contacte amb l'aigua (o l'orina), hidratant-ho i estenent-ho per a evitar la humitat. La microscòpia d'expansió consisteix a emprar un compost similar que s'hidrata en contacte amb l'aigua i es propaga tridimensionalment. En concret, en aquesta nova tècnica s'utilitza la composta N,N-dimetilacrilamida (DMAA) que polimeritza juntament amb l'acrilato sòdic (SA) per a formar una matriu o gel tridimensional. Aquest gel es diposita en aigua destil·lada capturant molècules d'aigua en el seu interior i té la capacitat d'estendre's en tres dimensions fins a 10 períodes. Amb aquesta propietat es tractaria d'estendre les estructures biològiques juntament amb el gel de DMAA [5].
El primer que cal fer és fixar la nostra mostra biològica. El procés de fixació immobilitza a la cèl·lula, mantenint-la en un moment donat i detenint les reaccions químiques de la cèl·lula. Així, la cèl·lula es congela en el temps i no es degrada en els següents passos.
Una vegada fixada, la mostra ha de marcar-se fluorescent, ja que com s'ha dit, la majoria de les estructures biològiques són incolores. Un dels mètodes més utilitzats per a la seva obtenció és el basat en anticossos. Els anticossos són proteïnes que es coneixen i enllacen específicament amb altres molècules o estructures. Si a aquests anticossos se'ls adhereix un conjugat fluorescent, poden utilitzar-se per a localitzar i detectar la molècula que volem estudiar.
Una vegada marcada la mostra per fluorescència, s'ancorarà a la sala de DMAA. Aquest procés d'ancoratge és imprescindible i constitueix un dels passos més importants de la microscòpia d'espantardo, que assegura la propagació de la mostra biològica juntament amb la sala. En aquest ancoratge, les molècules fluorescents que marquen la posició de les estructures d'interès s'uneixen al polímer DMAA mitjançant un enllaç covalent. D'aquesta manera, els fluoroforos queden lligats a l'aula i mantenen una posició relativa amb la resta de fluoroforos.
Una vegada finalitzat el procés d'ancoratge, el gel de DMAA i les molècules fluorescents de la nostra mostra es converteixen en una única entitat, la qual s'expandeix entre si i entre si. Per fi ha arribat el moment d'estendre la nostra mostra. No obstant això, caldrà fer front a un últim problema, ja que les cèl·lules posseeixen unes estructures rígides anomenades citoesquelets i matriu extracelul·lar, que formen una bastida per a mantenir la forma de la cèl·lula i el teixit i ajudar a combatre les deformacions mecàniques. Si s'intenta la seva difusió a partir d'aquest punt, les forces de cohesió provocades per aquestes estructures s'oposaran a les forces d'expansió del gel, trencant i distorsionant la nostra mostra. Per a evitar-lo cal digerir la mostra. En aquest procés digestiu, la mostra és tractada amb un enzim anomenat Proteinasa K, que curta i dissipa totes les proteïnes que componen el citoesquelet i la matriu extracelul·lar, i permet la destrucció i expansió de la bastida que manté la grandària cel·lular.
Ara que hem desfet el citoesquelet i la matriu extracelul·lar, podem hidratar i estendre la nostra habitació. En aquest procés, la molècula d'aigua absorbeix els gels de DMAA i s'acumulen en el seu interior, inflant l'habitació com un globus. Atès que el gel de DMAA està format per una matriu tridimensional simètrica, l'expansió també es produeix en tres dimensions i la nostra mostra biològica està ancorada a la sala i es propaga amb ella. Així, una cèl·lula de 30 micres, per a nosaltres invisible, pot estendre's fins a 10 vegades en totes les seves dimensions, fins a 300 micres (0,3 mm). Molècules que abans estaven a una distància de 25 nm, i que només podien ser separades per un microscopi de superresolución, ara estan a una distància de 250 nm i poden ser examinades en fluorescència convencional amb un microscopi. La microscòpia d'escriptura espacial facilita, per tant, l'accés al món nanoscópico als qui no puguin realitzar inversions milionàries en això.
La microscòpia d'expansió, per tant, proporciona un accés directe als descobriments d'aquells que no tenim accés a programari o aparells sofisticats, de manera que aquesta possibilitat no quedi en mans d'uns pocs. Pot dir-se que permet anar més enllà de la situació econòmica dels grups científics i que l'accés a la informació depèn de les habilitats científiques, com en altres èpoques, i no tant dels diners. Així, qualsevol tema —com en el seu moment va ser Mary Anning— seria capaç de realitzar troballes tan significatives com l'esquelet de l'ictiosauro, amb uns pocs materials disponibles.
BIBLIOGRAFIA
[1] Nieto Garai JA., Lorizate M. i Contreras FX. 2021. “Shedding light on membrane rafts structure and dynamics in living cells. Biochimica et biophysica acta. Biomembranes, 1864, 183813.
[2] Balzarotti F., Eilers I. C. Gwosch, Gynna A. Westphal V. Stefani F. Elf J. i Hell S. 2017. “Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes”. Science 355, 606-612.
[3] Chen F., P. Tillberg W. i Boyden E. S. 2015. “Expansió microscopy”. Science 347, 543–548.
[4] Faulkner E. Thomas S. i Neely R. 2020. “An introduction to the methodology of expansion microscopy”. The International Journal of Biochemistry & Cell Biology, 124, 105764.
[5] Truckenbrodt S., Maidorn M., D. Crzan, Wildhagen H. Kabatas S. i Rizzoli S. 2018. “X10 expansion microscopy enables 25-nm resolution on conventional microscopes”. EMBO reports, 19, e45836.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia