Ikusezina ikusarazten: espantsio-mikroskopia
2022/08/31 Jon Ander Nieto Garai - Biokimika eta Biologia Molekularreko doktoratu osteko ikertzaileaEHU | June Olazar Intxausti - Biokimika eta Biologia Molekularreko doktoradutza aurreko ikertzaileaEHU Iturria: Elhuyar aldizkaria
Nola behatu daitezke egitura nanoskopikoak milioi bat euro xahutu gabe? Punta-puntako mikroskopia-aurkikuntzak beti egon izan dira unean uneko zientzialari dirudun gutxi batzuen eskura. Horri aurre egiteko asmotan, ez da asko hurrengo hau otu zitzaion zientzialari-talde bati: mikroskopioarekin ezin baditugu ikusi egitura nanoskopikoak, zergatik ez handitu egituron tamaina? Horrela jaio zen gaur egun espantsio-mikroskopia izenaz ezagutzen duguna.
XIX. mendean fisikarekin gertatu zen bezala, gaur egun gutxi dira mundu makroskopikoan biologiaren alorrean egin daitezkeen aurkikuntzak. Amaitu dira Mary Anning paleontologo saiatuak, mailua eskuan eta motibazio hutsak gidaturik, Ingalaterrako hondartzetan desagertutako dozenaka espezie aurkitzen zituen egunak. Gaur egun, gure bizitzak gidatzen dituzten prozesu biologikoak ulertzeko eta aurrerapen esanguratsuak egiteko biologiaren eta medikuntzaren alorrean, begi hutsez ikusi ezin ditugun organismoak, egiturak, molekulak eta prozesuak aztertu behar ditugu.
Gizakiak 0,1 mm-ko tamaina duten objektuak bereiz ditzake. Tamaina hori baino txikiagoa den edozer mikroskopikotzat jotzen da, eta ezin dugu begi hutsez ikusi. Horretarako, behatu nahi dugunaren irudia handitzen lagunduko diguten tresnak behar ditugu; mikroskopioak, alegia.
Mikroskopio optikoa XVII. mendean hasi zen erabiltzen Europan, eta hesi makroskopikoa gainditzea eta mundu mikroskopikoan barneratzea ahalbidetu zuen horrek. Lehen mikroskopio optikoei esker, protozooak, bakterioak eta beste mikroorganismo ezezagun batzuk aurkitu ahal izan ziren, garaiko paradigma guztiz aldatuz. Baina aurkikuntza zientifiko askorekin gertatzen den bezala, mikroskopio optikoak galdera gehiago ekarri zituen erantzunak baino; izan ere, mundu mikroskopikoan, organismo askok ez dute kolorerik, gardenak dira, eta, beraz, tindatzeko metodoak asmatu behar izan zituzten behatu ahal izateko.
Modu berean, tindaketa horiek ehun, zelula edo organulu bat beste batetik bereizteko aukera ematen zuten arren, ez zuten informazio askorik ematen maila molekularrari zegokionez. Beraz, hasierako tinturen aurrerapauso gisa, XX. mendeko bigarren hamarkadan lehen fluoreszentzia-mikroskopioa garatu zen. Mikroskopio-mota horrek molekula fluoreszenteek igorritako argia erabiltzen du laginaren xehetasunak behatzeko.
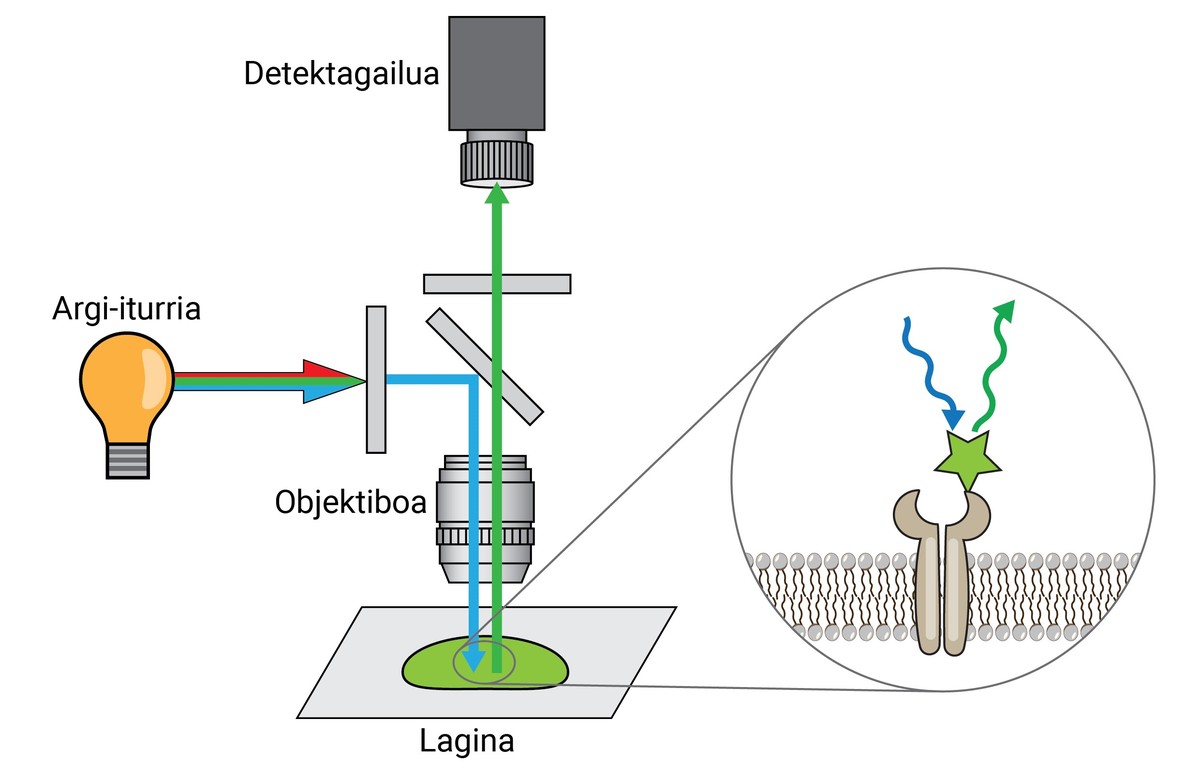
Puntako fluoreszentzia-mikroskopio batek 250 nm-ko distantzian edo urrunago dauden bi molekula edo egitura bereiz ditzake, eta bereizmen-gaitasun hori giza begiarena baino 400 aldiz handiagoa da. Erresoluzio-muga deritzo horri, eta mikroskopio baten ezaugarri garrantzitsuenetako bat da.
250 nm-ko muga hori, ordea, ez da nahikoa banakako molekulak bereizteko, eta, beraz, 1990eko hamarkadan superbereizmeneko mikroskopia garatu zen, zeinaren bereizmena 25 nm-raino iristen baita [1]. Duela gutxi, muga hori 3 nm-raino murriztea lortu da, MINFLUX izeneko superbereizmeneko teknikarekin [2]. Teknika horren bidez, 3 nm-ko distantziara dauden egiturak bereiz daitezke, hau da, giza ile bat baino 25.000 aldiz txikiagoak diren egiturak, hala nola molekula bakarrak.
Ikus daitekeenez, mikroskopiaren historian, hesi bat hautsi den bakoitzean, beste bat agertu da. Kasu askotan, hesi edo oztopo horiek teknikoak izan dira (nola lortu bereizmen handiagoa?), baina, adibidez, MINFLUX teknikarekin molekula bakar baten bereizmen-mugara iritsita, bestelakoa da aurkitu dugun hesia: hesi ekonomikoa. Zoritxarrez, bereizmena handitzearekin batera, orobat handitzen da superbereizmeneko mikroskopioen kostua. Orokorrean, azpiegitura oso garestiak eta software sofistikatuak behar dituzte, eta, horren ondorioz, laborategi gutxi batzuen eskura baino ez daude. MINFLUX mikroskopio berri batek, adibidez, 2 milioi euro balio du.
Laborategi gehienek, beraz, ezin dute azken hesi hori gainditu, eta fluoreszentzia-mikroskopio konbentzionalekin konformatu behar dute. Hala ere, 2015ean, ikerketa-talde batek nanoskopia laborategi horietara zabaltzeko modua aurkitu zuen, arazoari beste ikuspuntu batetik helduta: nire mikroskopioak ez badu behar adinako ahalmenik ikusi nahi dudan egitura bereizteko, zergatik ez handitu egitura hori? Horrela jaio zen espantsio-mikroskopia [3].
Espantsio-mikroskopia
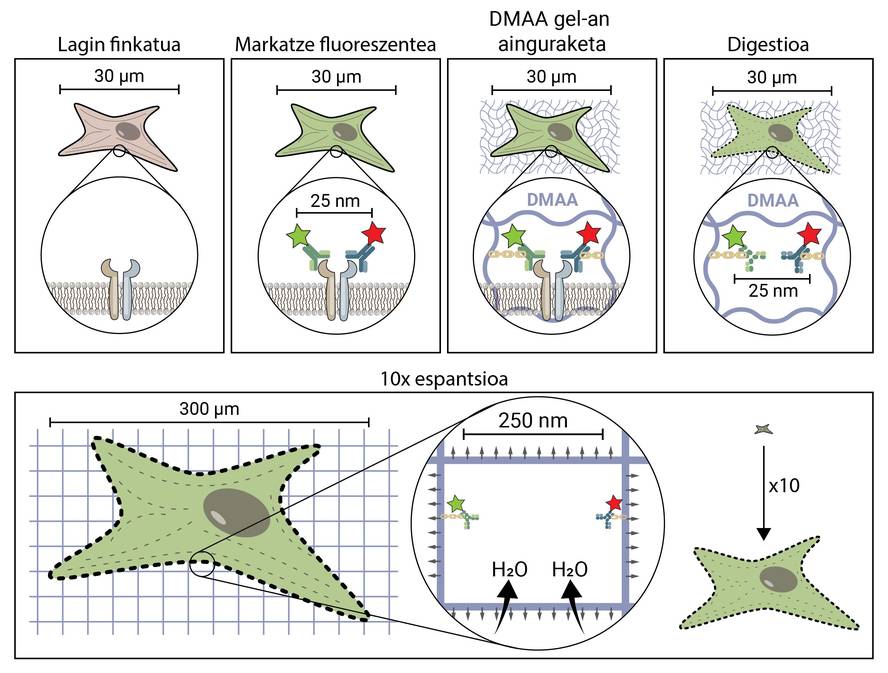
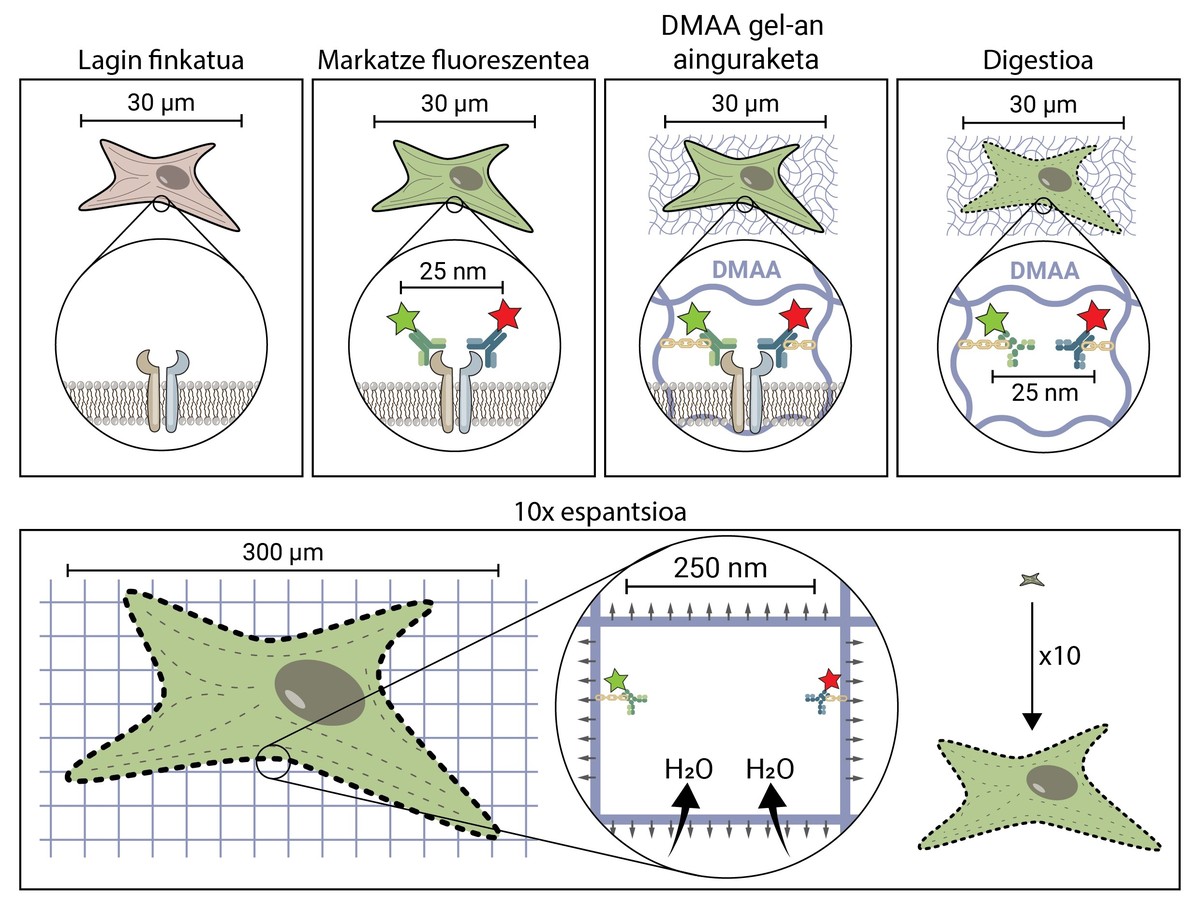
Espantsio-mikroskopiaren premisak nahiko sinplea dirudi kontzeptualki. Teknikoki, ordea, konplexua da. Teknika mikroskopiko tradizional batean, lagina molekula fluoreszentez markatzen da intereseko egiturak behatu ahal izateko, baina, gainerakoan, lagina bere horretan uzten da, eta, beraz, jatorrizko forma eta tamaina mantentzen ditu. Espantsio-mikroskopian, egitura oso txikiak bereizi ahal izateko, lagina hiru dimentsiotan hedatzen da, fluoreszentzia konbentzionaleko mikroskopio batekin behatzeko behar adinako tamaina lortu arte [4].
Baina, nola hedatzen da lagin biologiko bat, zelula bat, jatorrizko tamaina baino 10 aldiz handiagoa izatera iritsi arte? Sekretua pixoihaletan dago. Pixoihalek gel bat dute, urarekin (edo gernuarekin) kontaktuan likidoa xurgatzen duena, hidratatuz eta hedatuz, hezetasuna saihesteko. Espantsio-mikroskopiak antzeko konposatu bat erabiltzen du, urarekin kontaktuan hidratatu eta hiru dimentsiotan hedatzen dena. Zehazki, teknika berritzaile honetan N,N-dimetilakrilamida (DMAA) konposatua erabiltzen da, akrilato sodikoarekin (SA) batera polimerizatu eta matrize edo gel tridimentsional bat sortzen duena. Gel hori ur destilatuan jartzean, ur-molekulak harrapatzen ditu barruan, eta hiru dimentsiotan 10 aldira arte hedatzeko gaitasuna du. Propietate hori baliatuz, helburua litzateke egitura biologikoak DMAAzko gelarekin batera hedatzea [5].
Lehenik eta behin, gure lagin biologikoa finkatu behar da. Finkatze-prozesuak zelula immobilizatzen du, une jakin bateko egoeran mantenduz eta zelularen erreakzio kimikoak geldituz. Horrela, zelula denboran izoztu egiten da, eta ez da degradatzen hurrengo urratsetan.
Behin finkatuta, lagina fluoreszenteki markatu behar da, lehen esan bezala egitura biologiko gehienak koloregabeak baitira. Hori lortzeko metodoen artean erabiliena antigorputzetan oinarritzen da. Antigorputzak beste molekula edo egitura batzuk ezagutu eta horietan espezifikoki lotzen diren proteinak dira. Antigorputz horiei konjugatu fluoreszente bat itsasten bazaie, aztertu nahi dugun molekula aurkitzeko eta detektatzeko erabil daitezke.
Lagina fluoreszentziaz markatu ondoren, DMAAzko gelean ainguratu behar da. Ainguratze-prozesu hori ezinbestekoa da, eta espantsio-mikroskopiaren urratsik garrantzitsuenetako bat da; izan ere, lagin biologikoa gelarekin batera hedatzen dela ziurtatzen du. Ainguratze horretan, gure intereseko egituren kokapena markatzen duten molekula fluoreszenteak lotura kobalente baten bidez lotzen zaizkio DMAA polimeroari. Hala, fluoroforoak gelari lotuta geratzen dira, eta gainerako fluoroforoekiko posizio erlatiboa mantentzen dute.
Ainguratze-prozesua amaitu ondoren, DMAAzko gela eta gure lagineko molekula fluoreszenteak entitate bakar bihurtzen dira: bata bestearekin eta elkarrekiko hedatzen dira. Iritsi da azkenean gure lagina hedatzeko unea. Haatik, azken arazo bati aurre egin beharko diogu; izan ere, zelulek zitoeskeleto eta zelulaz kanpoko matrizea deritzen egitura zurrunak dituzte, zeinek zelularen eta ehunaren forma mantentzeko eta deformazio mekanikoei aurre egiten laguntzeko aldamio moduko bat osatzen baitute. Lagina horrela egonik hedatzen saiatzen bagara, egitura horiek eragindako kohesio-indarrek kontra egingo diete gelaren espantsio-indarrei, eta gure lagina hautsiko eta desitxuratuko dute. Hori saihesteko, lagina digeritu behar da. Digestio-prozesu horretan, lagina Proteinasa K deritzon entzima batekin tratatzen da, zeinak zitoeskeletoa eta zelulaz kanpoko matrizea osatzen duten proteina guztiak ebaki eta digeritzen baititu, eta zelularen tamaina mantentzen duen aldamioa suntsitzen eta hedapena ahalbidetzen baitu.
Orain, zitoeskeletoa eta zelulaz kanpoko matrizea desegin ditugunez, gure gela hidratatu eta hedatu dezakegu. Prozesu horretan, ur-molekulak DMAAzko gelak xurgatzen ditu eta barruan metatzen dira, gela globo bat bezala puztuz. DMAAzko gela hiru dimentsioko matrize simetriko batez osatuta dagoenez, espantsioa ere hiru dimentsiotan gertatzen da, eta, gure lagin biologikoa gelari ainguratuta dagoenez, harekin batera hedatzen da. Horrela, 30 mikrometroko tamainako zelula bat, guretzat ikusezina, 10 aldiz heda daiteke dimentsio guztietan, 300 mikrometroko tamainara arte (0,3 mm). Lehen 25 nm-ko distantziara zeuden molekulak, zeinak superbereizmeneko mikroskopio batekin bakarrik bereiz baizitezkeen, 250 nm-ko distantziara daude orain, eta ohiko fluoreszentzia-mikroskopio batekin azter daitezke. Espantsio-mikroskopiak, beraz, mundu nanoskopikorako sarrera errazten die horretan milioi askoko inbertsioak egin ezin dituztenei.
Espantsio-mikroskopiak, beraz, aurkikuntzak egin ahal izateko lasterbide bat eskaintzen digu software edo aparatu sofistikatuetara heltzeko aukerarik ez dugunoi, aukera hori ez dadin geratu gutxi batzuen eskuetan. Esan daiteke aukera ematen duela talde zientifikoen egoera ekonomikotik harago joateko eta informazioaren eskuragarritasuna trebetasuna zientifikoen araberakoa izateko, garai batean bezala, eta ez hainbeste diruaren araberakoa. Hala, edozein litzateke gai —garai batean Mary Anning izan zen bezala— iktiosauroaren eskeletoa bezain aurkikuntza esanguratsuak egiteko, eskura dauden material gutxi batzuk baliaturik.
BIBLIOGRAFIA
[1] Nieto-Garai JA., Lorizate M. eta Contreras FX. 2021. “Shedding light on membrane rafts structure and dynamics in living cells. Biochimica et biophysica acta. Biomembranes, 1864, 183813.
[2] Balzarotti F., Eilers Y., Gwosch K., Gynna A., Westphal V., Stefani F., Elf J. eta Hell S. 2017. “Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes”. Science, 355, 606-612.
[3] Chen F., Tillberg P. W. eta Boyden E. S. 2015. “Expansion microscopy”. Science, 347, 543–548.
[4] Faulkner E., Thomas S. eta Neely R. 2020. “An introduction to the methodology of expansion microscopy”. The International Journal of Biochemistry & Cell Biology, 124, 105764.
[5] Truckenbrodt S., Maidorn M., Crzan D., Wildhagen H., Kabatas S. eta Rizzoli S. 2018. “X10 expansion microscopy enables 25-nm resolution on conventional microscopes”. EMBO reports, 19, e45836.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia