Entropie et vie
1992/01/01 Mijangos Ugarte, Fernando | Garate Castellano, Kristina Iturria: Elhuyar aldizkaria
Le but de cet article est d'expliquer et de filmer le conflit entre la thermodynamique et la vie, ou si les deux ne sont pas opposés à certains points, sans proposer, bien sûr, une théorie circulaire. Pour cela, nous devons reconnaître que nous nous appuierons sur la thermodynamique classique macroscopique et sur l'évolution chimique de la vie. Nous savons aussi qu'il existe un autre type de thermodynamiques (qui peuvent être mieux adaptées pour décrire des processus irréversibles comme la vie, et qui sont mentionnés dans cet article) et d'autres théories sur la genèse de la vie (comme celle de Dieu ou celle de la panspernia), mais nous n'aborderons que celles déjà mentionnées.

Notre objectif est d'utiliser le plus petit nombre de formules mathématiques et chimiques possible pour faciliter leur compréhension, même si de temps en temps il a été impossible d'éviter l'une ou l'autre.
La thermodynamique classique macroscopique est basée sur trois postulats auxquels aucune exception n'a été trouvée. Les deux premiers peuvent être facilement définis, ceux qui ont une importance pour notre objectif.
Le premier postulat dit que l'énergie ne peut être produite ni détruite, même si elle peut être changée d'une manière à l'autre. Autrement dit, l'énergie de l'Univers est constante. Ce postulat a des implications directes, par exemple, lorsque tous les systèmes se déplacent spontanément pour obtenir la moindre énergie, c'est-à-dire que les corps tombent de haut en bas et ne se relèvent pas en eux-mêmes.
L'eau va toujours de haut en bas et nous n'avons jamais vu que l'eau va de bas en haut, ou l'avion tombe sans moteur. Il existe d'autres observations de ce type liées à ce postulat. Par exemple, l'eau chaude est placée avec la glace et fondue, ou les piles du transistor sont épuisées, etc. D'une certaine façon, on a tendance à abaisser la pente en parlant énergétiquement.
Bien que les affirmations ci-dessus soient appropriées pour comprendre et intérioriser, le premier principe de la thermodynamique ne peut pas répondre aux questions suivantes: Avez-vous déjà vu diviser une grande masse d'eau en deux, une partie d'eau chaude et une autre de glace? Ou que l'air d'un globe se concentre sur une extrémité laissant l'autre partie vide? Apparemment, le principe d'énergie minimale dans les processus qui se produisent n'est pas suffisant pour expliquer la spontanéité, et la thermodynamique pose un nouveau postulat.
Le deuxième principe stipule que: Dans tous les processus qui ont lieu dans l'univers, le désordre augmente, c'est-à-dire augmente l'"entropie". Ce mot est d'origine grecque et signifie chaos ou désordre. On dit conceptuellement que les systèmes ordonnés ont peu d'entropie et que les systèmes désordonnés ont beaucoup d'entropie. L'ordre/désordre est également utilisé comme compteur dans les sciences humaines. Dans la nature, il commande l'attitude du désordre. Les salles de classe sont naturellement désordonnées et nous devons faire un travail de tri. De cette masse d'eau on ne peut donc pas séparer proprement l'eau chaude de la terreur, puisque cette distribution implique la création d'un ordre.
Du point de vue thermodynamique, les êtres vivants peuvent être définis comme des régions localisées où l'ordre augmente. C'est-à-dire que l'apparition et la permanence de la vie sur Terre, en passant des structures aux structures organisationnelles qui ont la capacité de transmettre l'information (comprise comme une définition large de la vie), suppose un processus d'ordination qui pourrait supposer une contradiction avec le deuxième principe. Ainsi, des difficultés ou des malentendus apparaissent parfois.
A partir de maintenant nous nous plongerons dans eux. Il faut se rappeler que la vie et sa durée ne sont pas un processus isolé, mais un système ouvert, avec son environnement, avec lequel l'énergie et la masse sont échangées. Par conséquent, le processus de gestion du système implique simultanément le processus de dégestion de la zone et la somme des deux est dirigée vers le désordre. Cela semble paradoxal, mais c'est le cas.

Nous croyons que les processus qui ont dû se produire il y a 4,6 milliards d'années depuis la constitution de la Terre par condensation de la nébuleuse, jusqu'à l'apparition des premiers organismes unicellulaires les plus simples de la vie, 1 milliard d'années plus tard, ont été très compliqués et inertes. Ils se sont probablement produits à travers une série infinie de petits événements, et à chaque fois qu'ils étaient produits, il était impossible de reculer, c'est à dire, c'était un processus irréversible. Comme vous pouvez le déduire facilement, nous devrions utiliser la thermodynamique des processus irréversibles, mais ce n'est pas notre objectif.
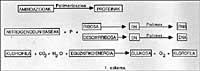
En suivant la ligne, nous pouvons considérer qu'à cette époque la Terre était entourée d'atmosphères réfléchissantes, sans décrire en détail sa composition chimique. Nous devons dire que l'oxygène moléculaire (02) n'était pas libre, donc les oxydations ne pouvaient pas se produire. Il est proposé que cette atmosphère pourrait être formée par N2, CO, NO, H2O, NH3, formant toujours une atmosphère non oxydante, différente de celle actuelle. Dans ce type de mosphère rédactrice, on a constaté que grâce à la lumière ultraviolette émise par le Soleil (il faut rappeler qu'à l'époque il n'existait probablement pas d'ozone) et à toute l'énergie apportée par l'activité volcanique et les tempêtes, ces gaz inertes ont réagi. Par exemple, en 1953, S. Miller a démontré que dans cette atmosphère on obtenait beaucoup de composés chimiques chars, et ce qui est surprenant, ce sont des composés chimiques basés sur la vie! Voir figure 1.
Reconnaître que le passage de l'inorganique à l'organique peut être très simple et savoir que c'est quelque chose d'éternel (comme l'affirmation que la Terre est ronde), nous le savons par une expérience réalisée par Wöhler en 1832 (il a montré qu'un composé inorganique, cyanate ammoniaque, pouvait obtenir un composé organique chauffé, urée). On a toujours considéré que le cadre organique était lié à une force motrice inconnue, appelée "force vitale". Aujourd'hui, nous savons que le passage d'un champ à un autre est absolument chimique.
Lors des séances de Miller, il a été démontré que de nombreux composés organiques déchus de l'atmosphère étaient emballés dans l'eau (voir figure 1 et description de l'essai). Le passage de ces matières premières inorganiques à ces composés organiques implique le passage d'un désordre à un ordre, le tout en raison de l'énergie solaire. En quelque sorte, il est utilisé pour commander l'énergie.
Polymérisation
Expliquer pourquoi ces molécules monomères se sont unies pour devenir des structures chimiques organiques complexes (qui ont la capacité de stocker des informations chimiques), il est beaucoup plus difficile d'expliquer pourquoi le processus connu sous le nom de polymérisation a eu lieu, et nous allons faire quelques considérations pour les éclaircir.
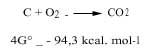
Les chimistes ont étudié deux aspects de la thermodynamique, à savoir le postulat de l'énergie minimale et l'entropie, pour savoir si une réaction chimique peut se produire naturellement ou non. Pour conjuguer ces deux positions, nous utilisons le changement énergétique de Gibbs : si à une température déterminée l'énergie de Gibbs diminue, nous disons que cette réaction peut se produire spontanément. Par exemple, le charbon est brûlé avec l'oxygène, car la variation énergétique de ses Gibbs est négative, comme on peut le voir dans la réaction suivante (c'est pourquoi l'atmosphère oxydante dans laquelle l'oxygène est libre est oxydant):
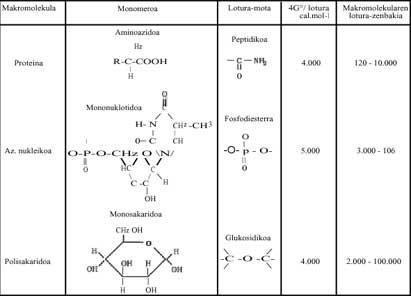
Dans les processus de polymérisation, lorsque les molécules simples (monomères) doivent former des sucres, lipides, protéines, acides nucléiques, etc., l'énergie de Gibbs augmente, donc il ne semble pas que la réaction puisse se produire spontanément (voir modification énergétique modifiée de Gibbs de certains des polymères écrits dans le tableau 1 ci-dessous). Que faire ? Dans les êtres vivants, dans nos corps, nous avons répondu en disant que ces réactions se produisent toujours (sinon nous serions morts), mais comment et pourquoi se produisent ?
Il faut dire que les réactions intracellulaires (considérées pour des éléments vivants simples) ne se produisent pas dans des systèmes isolés, mais que la cellule elle-même est un système ouvert, c'est-à-dire qu'il existe un échange. Les réactions de polymérisation sont dues au fait que d'autres réactions très exergoniques se produisent simultanément (dont elles libèrent de l'énergie de Gibbs).
Ces réactions exergiques sont celles qui libèrent beaucoup d'énergie. Métaphoriquement parlant, ils sont chimiques locaux solaires. Cette énergie libérée aide à la polymérisation. Sans Bes, nous parlons d'Adenosin Triphosphate (ATP) qui libère beaucoup d'énergie libre en hydrolysant. Toutes les polymérisations qui se produisent chez les êtres vivants sont dues à l'ATP (voir tableau 1). Vous pouvez écrire brièvement:

La molécule d'ATP est appelée stockage d'énergie. Certaines polymérisations peuvent se produire sans ATP, probablement parce que des molécules équivalentes comme celle-ci interviennent.
Si les polymérisations actuelles se produisent grâce à l'ATP, étant un mécanisme totalement universel, comment pouvait-on produire à l'époque mentionnée ? L'ATP s'était-il déjà formé dans cette évolution chimique de la vie ? Ces questions, bien sûr, n'ont rien à voir avec la thermodynamique et nous, les chimistes, ne pouvons pas les répondre correctement. Cependant, dans ce tableau 2, plusieurs molécules ont été écrites qui ont pu être utilisées comme "soleil local" et qui peuvent être facilement synthétisées dans les essais réalisés par Miller. Par hasard ? Ce qu'il faut dire, c'est que les processus de polymérisation, c'est-à-dire le passage du désordre à l'ordre, ont pu se produire à l'aide de réactions qui libèrent de l'énergie libre (ou de l'énergie de Gibbs).
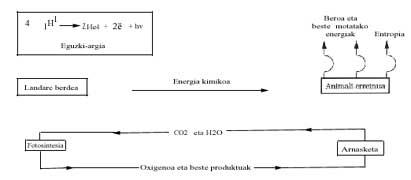
Du point de vue énergétique, on analyse ensuite le bilan énergétique de la vie actuelle et ses conséquences possibles. Nous savons que le soleil émet beaucoup d'énergie et effectue un long voyage et effectue des "filtres" dans l'atmosphère terrestre (couche d'ozone, etc.) Une fois dépassée, elle atteint la surface terrestre. L'énergie visible est utilisée uniquement dans le processus appelé photosynthèse, où le glucose (C6H1206) des matières premières CO2 et H2O est synthétisé. Bien que le changement énergétique de Gibbs soit endergonique dans cette réaction, l'énergie fournie par le Soleil permet sa réalisation, selon l'équation suivante :

Les plantes vertes utilisent ce glucose la nuit (au crépuscule) et la brûlent à l'oxygène pour pouvoir effectuer d'autres processus de polymérisation avec l'énergie libérée. Le règne animal exploite (mange) le travail chimique de la photosynthèse des plantes vertes et obtient de l'énergie grâce à la combustion de glucose (ou de graisse ou d'autres substances).
Si cette combustion se produisait comme la combustion du bois ou du charbon dans le feu, on pourrait immédiatement en déduire que seul le "corps" serait brûlé, c'est-à-dire que l'énergie libérée dans cette combustion romprait les liaisons chimiques des composés biochimiques qui seraient dégradés par l'administration de C02 et H2O.
L'évolution de la vie, Nature, plus rapide qu'ici exposé, a subi une évolution naturelle à travers un mécanisme de libération progressive de cette énergie, qui l'accumule en plus comme énergie chimique. Cette molécule d'ATP nous vient à nouveau à la tête.
Les êtres vivants consommaient de l'énergie pour effectuer différents types de travail, à savoir des processus qui ne se produiraient pas par eux-mêmes comme défini par la thermodynamique classique macroscopique. Ces processus peuvent être exprimés comme :
- Les oligo-éléments et matières premières, c’est-à-dire la «nourriture», doivent être transportés, transportés et transportés dans toutes les cellules qui composent l’entité vivante. Pour cela, il faut travailler et cette concentration et/ou transport n'est pas facile. Vous êtes-vous déjà demandé quelle lassitude il faut avoir à élever l’eau et les sels des racines jusqu’au sommet d’un arbre? ou comment est le pompage qui doit faire le cœur pour envoyer du sang jusqu'au doigt et l'énergie qu'il consomme? Il faut transporter et concentrer beaucoup de choses sur les corps.
- En outre, il faut beaucoup d'énergie pour polymériser, par exemple, pour synthétiser des molécules d'ADN qui ont la capacité de transmettre à leurs descendants des informations génétiques de leurs ancêtres. C'est-à-dire, pour assurer la survie de la vie, il faut de l'énergie. (En bref, nous restons vivants parce que nous nous nourrissons à court terme, mais seulement si nous nous reproduisons comme des espèces à long terme).
- Enfin, nous réalisons quelques travaux physiques comme la contraction des muscles… et tout travail qui dégage la chaleur. C'est-à-dire la chaleur qui dégage l'être vivant, qui absorbe le
milieu et donc augmente l'entropie locale. C'est pourquoi, dans ce processus naturel, vivant, l'entropie ou le désordre de l'univers augmente.
Selon ce qui précède, on peut affirmer que: Que l'apparition et le développement de la vie sur la planète Terre ne sont pas des processus contraires au deuxième principe de la thermodynamique. Nous avons voulu expliquer l'un d'eux qui respecte le principe. Si nous disons que la vérité est ronde, nous devrions reconnaître que nous n'avons fait qu'une approximation, et dans les lignes qui suivent nous essaierons de la mettre en évidence.
D'une part, la thermodynamique classique macroscopique utilisée prédit les changements qui peuvent se produire dans les systèmes macroscopiques équilibrés et est ainsi appliquée à la cellule. Cependant, en réfléchissant, nous réaliserons la faiblesse de cette approche. Nous savons que la cellule est très microscopique. Par conséquent, les concentrations macroscopiques et les concentrations sur elles peuvent être très différentes. De plus, la cellule n'est pas un système isolé, mais ouvert, comme mentionné ci-dessus, ce qui en fait un système non équilibré et non équilibré. Cependant, la concentration de beaucoup de matières premières reste pratiquement constante au fil du temps. C'est pourquoi cette situation est appelée état stationnaire (faux équilibré).
L'apparition de la vie a été essentiellement un processus naturel et donc irréversible. Dans ce cas, il serait beaucoup plus approprié d'utiliser une thermodynamique irréversible que la thermodynamique classique, dont la description est en dehors de cet article.
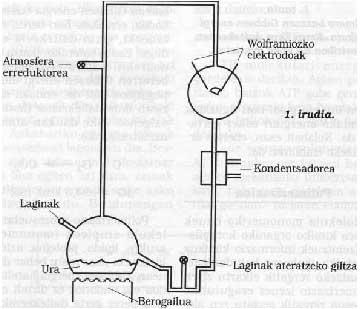
À l'Université de Chicago S. Miller et H. Schéma de l'outillage utilisé par Urey. Ses conditions expérimentales étaient simulées sur la Terre primitive. De la clé de gauche, on introduisit une atmosphère de gaz rédacteurs, qui s'excitait par une forte étincelle électrique (à l'époque on peut considérer l'énergie émise par le Soleil). L'eau du flacon inférieur était chauffée (à l'époque la Terre était considérée comme très chaude) et refroidie par un condenseur tombant sous forme de goutte de pluie. Les composés dissous dans ces gouttes d'eau s'accumulaient au fond et avec la clé de celui-ci on prélevait périodiquement des échantillons.
15% de tout le carbone méthane introduit dans ces sessions était devenu un composé biochimique, comme la glycine, l'alanine, l'acide glutamique, l'urée, etc. (au moins une vingtaine de composés différents) et un autre grand pourcentage sous forme de sable goudronné. Il est surprenant que la plupart des acides aminés qui forment les protéines puissent être obtenus dans ces sessions et plus encore dans la plupart des composés qui soutiennent la vie. Est-ce un pur hasard ou la vie pourrait apparaître avec l'évolution de ces composés?


Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia