Gaixotasun genetikoen korapiloa askatzen
2017/03/01 Garcia Etxebarria, Koldo - Genetikan doktoreaEHUko Genetika, Antropologia Fisikoa eta Animalia Fisiologia saila Iturria: Elhuyar aldizkaria

Gaixotasun askoren oinarria, 14.000 ingururena, genomako akatsetan dago. Gaixotasun horiek bi talde handitan sailka daitezke: batetik, gene bakarrak eragiten duenean, gaixotasun monogeniko edo mendeldar deitzen zaienak ditugu; eta, bestetik, gene batek baino gehiagok parte hartzen dutenean, gaixotasun genetiko konplexu izenez ezagutzen direnak. Gaixotasunekin lotutako geneak zeintzuk diren aurkitzea da lehen pausoa; ezinbestekoa, haiei sendabidea aurkitzeko. Azken urteetan aurrerapauso handiak egin badira ere gene akastun horiek zein diren jakiteko, haiek konpontzeko bidea ez dago hain argi.
Gene bakarrek eragiten dituzten gaixotasunak, 4.000 inguru, izan ziren aztertzen lehenak. Mendelen legeek aurresaten dituzten patroiak jarraitzen dituztenez, errazagoa da gaixotasunarekin lotuta dagoen genea aurkitzea. Horretarako, familia batean gaixotasuna nola banatzen den aztertzen da, eta horren arabera sailkatu.
Sexualak ez diren 22 kromosometako batean kokatzen den gene baten ondorioz gertatzen denean, gaixotasun autosomiko esaten zaio. Autosomiko dominanteetan, genearen kopia akastun bakarra nahikoa da gaixotasuna garatzeko. Haien artean, maiztasun handienekoak dira hiperkolesterolemia familiarra (500 jaioberritatik batek pairatzen du), I motako neurofibromatosia (2.500etik batek) edota Huntingtonen gaixotasuna (15.000tik batek).
Gaixotasun autosomiko errezesiboetan, berriz, genearen bi kopiek izan behar dute akastunak gaixotasuna garatzeko. Anemia faltziformea (625etik batek), fibrosi kistikoa (2.000tik batek) eta Tay-Sachsen gaixotasuna (3.000tik batek) dira mota horretako gaixotasunik hedatuenak.
Kromosoma sexualei dagokienez, X kromosoman kokatzen diren geneekin lotutako gaixotasunen artean daude Duchenneren distrofia muskularra (7.000tik batek) eta hemofilia (10.000tik batek). Y kromosomaren kasuan, ordea, oso arraroak dira, eta, normalean, antzutasuna eragiten dute.
Adibide moduan gaixotasun monogeniko hedatuenak jarri baditugu ere, gaixotasun mendeldar gehienak gaixotasun arraroak dira; hots, 2.000 lagunetik batek baino gutxiagok pairatzen ditu. Hala ere, erantzulea zein gene den jakin ohi da. Susmatzen denean paziente batek gaixotasun bat duela, gene jakin hori sekuentziatu daiteke, eta, hala, baieztatu ezaguna den mutazio (sekuentziaren aldaketa) hori duen. Baina, gerta daiteke mutazio ezagun hori ez egotea, hau da, gaixo horrek mutazio berri bat izatea. Mutazio berri hori bilatzeko, oso erabilgarriak dira azken urteetan garatu diren genoma osoko sekuentziazio-teknikak.
Gaur egun, gai gara pertsona baten gene guztien (20.000 inguru) eskualde funtzionalaren sekuentzia lortzeko (exoma izenez ezagutzen dena) eta gene horiek daramatzaten mutazioak aztertzeko. Ohikoa da hainbat aldaketa egotea, gizaki guztion material genetikoa ez baita guztiz berdina; gainera, aldaketa gehienek ez dute oztopatzen genearen funtzioa. Baina gaixoaren eta haren gurasoen exoma konparatuta, ondoriozta daiteke zein aldaketa jaso dituen gurasoengandik eta zein diren berriak, eta haietatik zeinek izan ditzaketen eragin kaltegarriak genearen funtzioan.
Beste alde batetik, gaixotasun genetiko konplexuak zabalduago daude populazioan, baina gaixotasun horien gene erantzuleak aurkitzea ez da hain erraza. Halako gaixotasunak dira asma, esklerosi anizkoitza edota diabetesa. Gainera, osagai genetikoa badute ere, inguruneak ere eragiten duenez, gaixotasunaren azterketa zailagoa da.
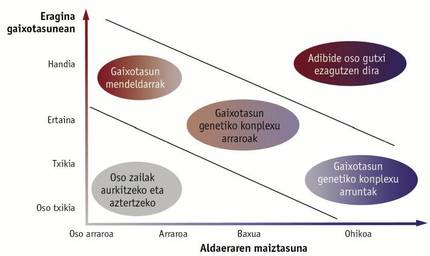
Parte hartzen duten geneak identifikatzeko, genoma osoko asoziazio-analisia izenez ezagutzen den teknika erabili izan da. Teknika horren bidez, genoma osoan barreiatuta dauden SNP (ingelesez, single nucleotide polymorphism, nukleotido bakarreko polimorfismoa) markatzaile genetikoak aztertzen dira. Halako milaka markatzaile aldi berean aztertzeko lanabesak garatu dira, microarray izenez ezagutzen direnak, eta, horrela, arin eta erraz jakin daiteke aztertutako pertsona bakoitzak SNPen zein aldaera daraman. Gaixotasuna duten pertsonetan SNPen aldaera bat ohikoagoa bada osasuntsuetan baino, susma daiteke aldaera hori gaixotasunarekin lotuta dagoela. Horrelako 2.400 ikerketa inguru egin dira, eta, guztira, ia 17.000 SNP lotu dira modu esanguratsuan gaixotasun edo ezaugarri konplexu batekin (1. irudia).
Hala ere, ez gara gai gaixotasun genetiko konplexuekin lotutako gene guztiak identifikatzeko. Badakigu gene gutxi batzuek gaixotasunean eragina dutela, baina gene horiek ez dira nahikoa gaixotasunaren garapena guztiz azaltzeko. Gaixotasun genetiko konplexu askoren auzia da SNP arrunt askoren konbinazioaren ondorio direla, eta SNP bakoitzak gaixotasuna izateko arriskua pixka bat igotzen edo jaisten duela (2. irudia). Gainera, SNP-multzo horrek ez du zertan gene batean egon; hots, ez du zertan gene batean akats bat sortu. Horrek zaildu egiten du SNP jakin bat edo batzuk gaixotasun batekin lotuta egotearen interpretazioa. Izan liteke SNP horiek benetan akatsa sortzen duen mutazio batetik gertu egotea eta egiazko eraginik ez izatea. Gerta liteke, halaber, SNPak genearen erregulazioan eragitea, eta, geneak akatsik ez badu ere, behar den mailan ez egotea. Oraindik lan handia dago egiteke gaixotasun genetiko konplexuen jatorri genetikoa ezagutzeko, eta etorkizun hurbilerako erronka izango da hori guztia argitzea.
Behin gaixotasun genetiko baten jatorria ezartzeko gai garenean, haren sendabidea aurkitzea izango litzateke hurrengo erronka. Orain arte, gaixotasunaren ondorioak arintzea edo gaixotasuna sor dezaketen ingurune-baldintzak saihestea izan dira konponbide arrakastatsu bakarrak. Izan ere, geneen akatsak zuzenean konpontzea, terapia genetikoa, ez da nahiko genukeen bezain arrakastatsua izan orain arte, eta horregatik, ez da orokortu.
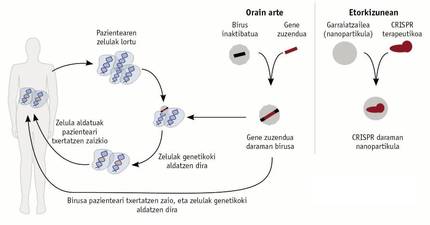
Gene jakin bat bere funtzioa betetzeko gai ez den kasuetan, saiakerak egin dira zenbait pazienteren material genetikoan ondo funtzionatzen duen gene bat txertatzeko (3. irudia). Horretarako, gene funtzional bat sartzen da birus eraldatu batean, gaixoari birusa tratamendu moduan ematen zaio, eta gene hori pazientearen zeluletako material genetikoan txertatzen du birusak. Estrategia hori immunoeskasia konbinatu larria zuten paziente batzuetan erabiltzen hasi ziren 1990. urtean, baina haren eraginkortasuna epe laburrekoa zen. Epe luzerako irtenbide bat bilatu nahian, teknika hobetu zen, eta, 2000. urtean, saiakera berriak egin zituzten. Zoritxarrez, saiakera berri horien albo-ondorio gisa, pazienteek leuzemia garatu zuten eta, ondorioz, saiakerak bertan behera utzi ziren. Albo-ondorio horren jatorria zen birusak beste gene batean sartzen zuela genearen kopia funtzionala, eta horrek leuzemia sortzen zuen.
2015. urtetik, badirudi terapia genikoen berpizte bat bizi dugula. CRISPR, zink-hatzak eta halako teknikak gai omen dira birusen erabilerak dituzten mugak eta arazoak saihesteko (3. irudia). Teknika horiek gai dira konpondu nahi den genea ezagutzeko, eta, hortaz, birusek ez duten espezifikotasuna dute. Teknika horiek zeresan handia ari dira ematen dagoeneko, eta, epe motzean, are handiagoa emango dute. Ikusi egin beharko da zer-nolako eraginkortasuna duten.
Gaixotasun genetikoen oinarriak ezagutzeko lanabesen garapenak aukera eman digu gaixotasun horiek askoz hobeto ulertzeko, eta badirudi sendabide eraginkorrak irudikatzen hasiak garela. Tentuz bada ere, baikorrak izan gaitezke, eta pentsa dezakegu etorkizun hurbilean iraultza bat biziko dugula gaixotasun genetikoen inguruan.
Bibliografia

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia