CRISPR, técnica de edición do xenoma: beneficios e inquietudes
2016/03/09 Etxebeste Aduriz, Egoitz - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
“Eu aínda non o uso, pero seguramente empezarei este ano”, afirma o xenético da UPV José Antonio Rodríguez Pérez. Rodríguez quere utilizar a técnica CRISPR paira investigar una mutación relacionada coa leucemia. Paira estudar o efecto desta mutación necesita células con mutación. “Até agora a única opción era tomar células dos pacientes, pero iso é moi difícil. É moito máis fácil meter esa mutación nas células que temos no laboratorio”. Pode facelo con CRISPR.

A técnica CRISPR serve paira editar o ADN con gran precisión. Pódense retirar os fragmentos de ADN onde se desexe e substituílos por outros novos. Iso non é novo, xa había outras técnicas paira facelo. “O máis importante é que simplificou e abaratado moito as cousas”, subliñou Rodríguez.
Outros instrumentos moi similares ao CRISPR, como TALLEN e ZFN. “Estes aparellos fan o mesmo que o CRISPR, pero paira utilizalos tes que deseñar e montar una proteína que é moi cara. Co CRISPR debes deseñar una molécula de ARN que é moi barata. Supoñamos que se necesitan 100 euros paira iso, pois coas técnicas anteriores necesitaríanse miles de euros”.
Democratización
Facilitar tanto as cousas abre moitas posibilidades. “Podes probar cousas diferentes. Moitos proxectos baséanse en probas e si tes que investir 5.000 euros, pois igual non vas empezar, pero se son 200 euros podes probalo”, explica Rodríguez. Ademais, “democratizou estes experimentos, que poderán ser realizados por moita xente que antes non podía. Antes non podiamos facer este tipo de proxectos pequenos laboratorios, pero agora si con CRISPR. Por iso estendeuse tan rápido e desta maneira exponencial”.
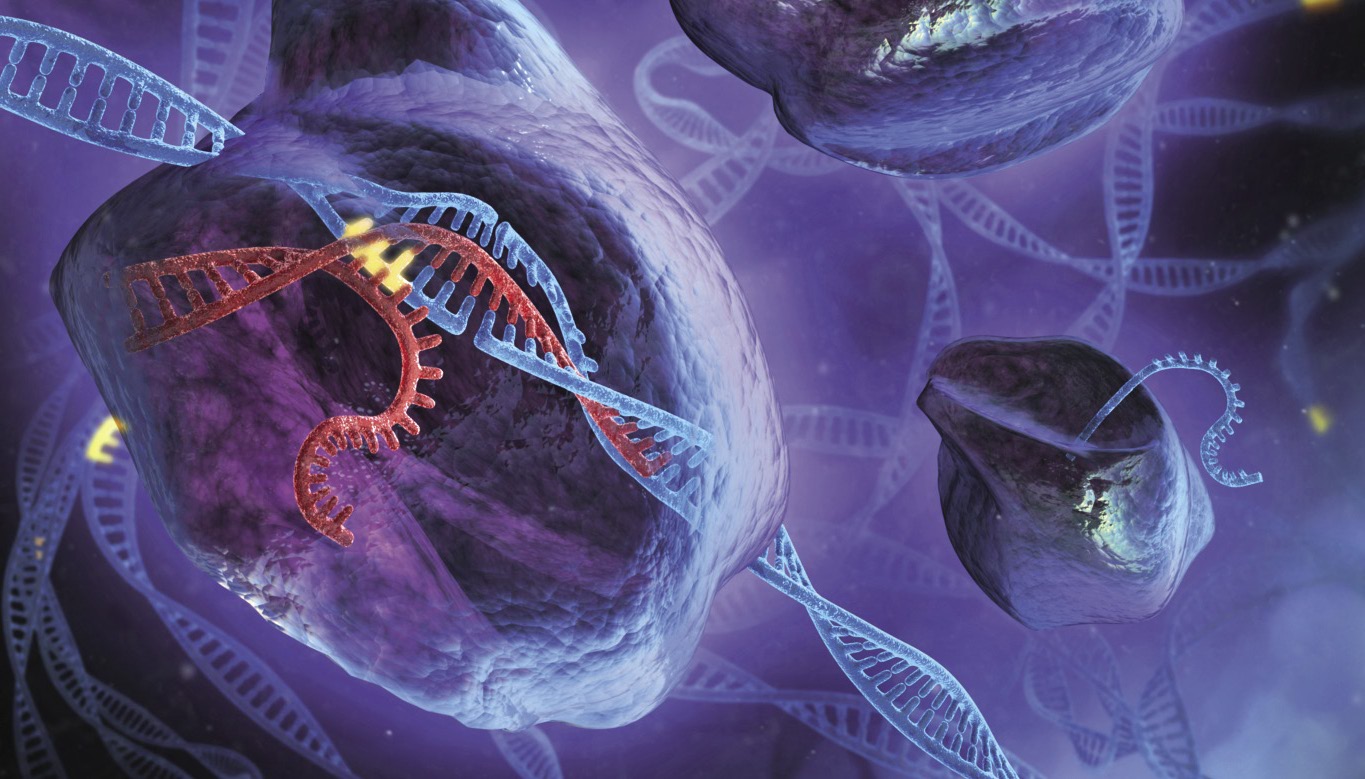
En 2012 publicouse Sciencen Jennifer Doudna e Emmanuelle Charpentier que o complexo encimático CRISPR-Cas9 de bacterias podía ser utilizado como ferramenta de edición xenética. Este complexo está formado por unha guía RNA e a encima Cas9. A encima curta o ADN no lugar que lle dá a guía RNA. Desta forma pódese editar o xenoma onde se desexe, sintetizando o RNA complementario ao lugar.
Ofrece enormes posibilidades de investigación básica e as súas aplicacións poden ser múltiples. A terapia génica é una das máis esperanzadoras. “Deuse un paso xigante”, afirma a xenética da UPV Ana Aguirre Escobal. “Até agora, coa terapia génica, ademais de ser moi cara, obtíñanse moi poucos bos resultados, porque a técnica non era boa. Agora, con todo, espérase que estes resultados melloren moito”.
Rodríguez está de acordo: “Nalgunhas enfermidades pode ser moi importante. En moitas enfermidades monogénicas está ben identificado o xene e os defectos e como corrixilos. Pero até agora non se podía corrixir un xene. Si un xene estaba mal, introducíase outra copia directa dese xene”. Esta copia introducíase a través dun vector e inseriríase aleatoriamente no xenoma, e había que esperar que ese xene cumprise a súa función. Agora pódese introducir a copia correcta no lugar que corresponde a ese xene, eliminando a anterior. “Agora os xenes pódense corrixir de verdade”, matiza Rodríguez.
Traballando o camiño cara á terapia
En 2014 investigadores do MIT utilizaron por primeira vez a técnica CRISPR paira curar una enfermidade en animais adultos. Foi utilizada no rato paira corrixir a mutación que produce a enfermidade hepática chamada tirosinemia en humanos. Conseguiron curar o mal, pero ao mesmo tempo, este traballo demostrou que a técnica tiña tamén algúns problemas a resolver.
Por unha banda, a técnica utilizada paira introducir a encima Cas9 e a guía ARN nas células do fígado, a inxección a alta presión, non é adecuada paira ser aplicadas en humanos. E doutra banda, só nunha das 250 células conseguiron corrixir a mutación. Neste caso bastou paira curar a enfermidade, pero é moi probable que non sexa en moitas outras enfermidades.
Doutra banda, “o CRISPR aínda ten efectos inespecíficos —engade Rodríguez—, ás veces pódese asociar o ARN noutra parte do xenoma. A técnica segue sendo optimizada, pero existe a posibilidade de mellorala. Por exemplo, até agora utilizouse a encima Cas-9, pero outras están a probar e poden ser máis específicas”.
O equipo do MIT que conseguiu curar a tirosinemia nos ratos xa conseguiu mellorar a técnica. En febreiro publicouse una forma máis segura e eficaz de chegar ás células do fígado dos ratos. A guía RNA e o fragmento directo de ADN foron introducidos por un virus e un RNA mensaxeiro que codifica a encima Cas9 mediante nanopartículas. Así, nunha de cada 16 células conseguiuse a corrección. E apenas detectaron efectos non específicos.
Hai máis exemplos, por exemplo, que en decembro tres grupos de investigación demostraron en artigos publicados simultaneamente en Science que no rato lograron mellorar a distrofia muscular Duchenne. A cuestión vai rápido, pero Rodríguez cre que aínda se vai a necesitar tempo paira aplicala en humanos: “Non creo que esteamos en condicións de facelo o ano que vén, pero dentro duns anos eu creo que será posible realizar cambios con gran precisión nos seres humanos. Logo teremos que comprobar si permítese ou como se controla”.
Preocupacións sobre a mesa
De feito, a medida que a capacidade da técnica foi quedando clara a súa contía, e á vista da rapidez coa que se está estendendo, tamén aumentaron as preocupacións éticas. “A sinxeleza é a parte positiva desta técnica, pero tamén a negativa, xa que “xogar” con esta ferramenta é fácil”, sinalou Rodríguez. “Eu vexo sobre todo aspectos positivos. E é que os riscos da técnica están aí, pero os doutras técnicas están como hai tempo”.
Outros, pola súa banda, outorgan maior importancia aos riscos. En marzo de 2015, un grupo de expertos opúxose ao CRISPR e ao resto de técnicas paira a transformación de embriones humanos nun artigo publicado na revista Nature. Estes expertos crían que isto podía ocorrer en breve. E un mes despois, investigadores da Universidade de Sun Yats en China publicaron a transformación de embriones humanos mediante a técnica CRISPR. Utilizaron embriones que non podían desenvolverse, pero o experimento acabou coas preocupacións xa existentes.
Ante esta situación, as academias de ciencia e medicamento estadounidenses, a Royal Society de Londres e a Academia Chinesa da Ciencia organizaron una reunión paira falar destas inquietudes. En decembro reuníronse en Washington 500 expertos de todo o mundo e chegaron a un acordo provisional: non prohibir a edición do xenoma humano de investigación, pero si a utilización de embriones modificados paira os embarazos.

“Una boa cousa da ciencia é que todo é moi público. Fálase e escóitase e tómanse decisións en función do que está a pasar”, afirma Aguirre. Aguirre é ex presidente do Comité de Ética da Investigación en Asuntos Biolóxicos e Organismos Modificados Xeneticamente da UPV/EHU, e o debate que se xerou agora con motivo do CRISPR non foi novo. “Recordo que nos anos 70, cando apareceron as primeiras técnicas de enxeñaría xenética, os expertos reuníronse en Asilomar (California). Decidiron impor una moratoria. Houbo que esperar uns anos paira comprobar que as técnicas eran seguras. Agora pasou algo parecido, falaron e acordado: ‘antes de empezar a falar das aplicacións, fagamos cociñas no laboratorio paira mellorar, optimizar e facer o máis seguro posible’.
O debate é antigo. “Cousas que até agora se vían afastadas ou moi teóricas, agora víronse máis próximas e factibles, o que resucitou un vello debate semi-morto nos últimos anos”. Ademais, Aguirre considera que hai outro factor que fixo aumentar a preocupación: “algúns advertiron que moitas leis que regulan e regulan organismos xeneticamente modificados, tal e como están redactadas, exclúen a técnica CRISPR”. De feito, nestas leis fálase da recombinación e do ADN estraño, pero na técnica do CRISPR non o hai. “Non teño ningunha dúbida de que estas leis se adaptarán paira regular a nova técnica, pero é certo que neste momento non se produciu”.
Con todo, a súa regulación ou regulación varía moito de país a país. En países como Xapón, China e India existen normas que prohiben realizar transformacións xenéticas en embriones humanos, pero non teñen efectos legais. A regulación en Rusia e Arxentina é moi ambigua.En Estados Unidos está prohibida o financiamento con diñeiro público, pero a lei non prohibe a aplicación clínica. E en Europa, en xeral, está prohibida na clínica e limitada á investigación. Recentemente no Reino Unido autorizouse aos investigadores do Instituto Francis Crick a utilizar a técnica CRISPR paira investigar o desenvolvemento de embriones humanos.
Medos e expectativas
As preocupacións e medos que xerou o CRISPR son de sempre. “Basicamente, no que se refire aos animais e as plantas hai que analizar ben se estas transformacións son seguras ou non, se os organismos que se xeran poden supor un risco paira o ser humano ou os ecosistemas”, explicou Aguirre. “En canto ao ser humano, creo que ás cuestións de seguridade engádese o concepto de individuo. Cando falamos de cambiar a secuencia de ADN pómonos nerviosos porque nos parece que dalgunha maneira vai influír na nosa individualidade”.
Con todo, Aguirre considera que na práctica o debate pasa a outro plano: “se temos cerca unha persoa con enfermidade xenética e hai una oportunidade de curala, entón é o que nos importa. Eu creo que cando se ve que ten aplicacións reais, que poden mellorar a vida das persoas, que a sociedade verá mellor estas técnicas”.
É o que sucedeu con moitos avances científicos. “Ocorreu con fecundación asistida. Ao principio era despreciable, pero aos poucos a sociedade demandouno, e os nenos nados coa fecundación xa asistida xa non ven como demos, como se vían os iniciais”.
Con todo, a transformación xenética pode ter aplicacións máis discutibles que a curación de enfermidades, como a transformación de embriones paira mellorar certas características. Con todo, Aguirre non ve polo momento demasiados motivos paira preocuparse, “Aínda que se ve máis cerca porque pode permitir a técnica, creo que aínda é una utopía, un medo teórico”.
Ademais, destaca que o control é rigoroso: “Calquera técnica de cambio xenómico, como a terapia génica, require pasar por diferentes comités. No Estado español, por exemplo, hai una comisión nacional moi esixente e hai que obter a súa autorización. Pero ademais, se se queren realizar probas nun hospital, hai que pasar tamén polos comités éticos dese hospital e da comunidade autónoma. Xa existe una estrutura e, en todo caso, ese control endurecerase a partir de agora, xa que non creo que a mellora xenética teña soporte social. Por tanto, non creo que haxa motivos de preocupación”.
Risco de transformación de ecosistemas
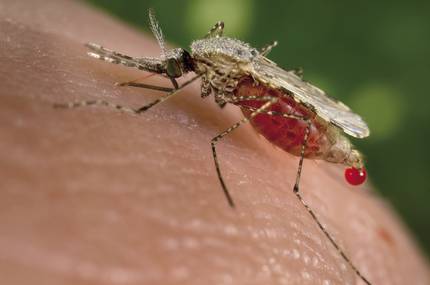
Outra das preocupacións é o efecto que os seres vivos modificados xeneticamente poden ter sobre os ecosistemas. E esas inquietudes foron suscitadas por outro traballo publicado en novembro. Científicos da Universidade de California crearon mosquitos transxénicos resistentes ao parásito responsable da malaria. Neste caso, ademais, grazas á técnica CRISPR, lograron que o 99% dos descendentes de mosquitos modificados herdan o xene do anticorpo e o xene fose activo neses mosquitos. Así, estimaron que 10 xeracións serían suficientes paira expandirse nunha poboación.
A capacidade de incidencia sobre a poboación xerou una gran preocupación. Aguirre tamén confía nos estritos controis que existen. “Outros mosquitos transxénicos contra a malaria, realizados mediante outra técnica, xa foron liberados. Pero paira iso tiveron que pasar 10 anos de controis. A obtención deste tipo de autorización require de numerosos e moi profundos estudos e avaliacións que permitan coñecer os riscos e beneficios. É certo que neses casos o risco cero non existe. Neste caso, tras pór todos os informes sobre riscos e beneficios sobre a mesa, e tendo en conta o enorme nivel de malaria, os políticos decidiron liberar os mosquitos transxénicos. En definitiva, é una ferramenta que pon a ciencia ao alcance da sociedade e que esta debe decidir que facer con ela”.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia