Terres rares
1990/11/01 Barrenetxea, Tere - Elhuyar Fundazioa Iturria: Elhuyar aldizkaria
On appelle terres rares les 17 métaux situés entre des éléments chimiques de numéro atomique 21 et 71, ainsi que les composés qui les produisent.
Ces dix-sept éléments sont: Trois éléments du groupe III b [Scan (Sc), Itrio (Y) et Lantano (La)] et la première des deux séries, communément appelées lanthanide, qui sont écrites en dehors du tableau périodique, composé de 14 éléments. Le nom de lanthanide est dû à sa descendance. La série de lanthanides se compose de: Cerio (Ce), Praséodyme (Pr), Néodyme (Nd), Prometio (Pm), Samario (Sm), Europio (Eu), Gadolinio (Gd), Terbio (Tb), Disprosion (Dy), Holmio (Ho), Blutitorio (Blu).
Histoire
Nom de terre rare, XVIII. Depuis le XXe siècle, date à laquelle les premières découvertes sur ces métaux ont été faites. La proportion de ces métaux était minimale dans les minéraux des études initiales. Face à cette pénurie, ces chercheurs ont cru qu'ils étaient très rares sur la surface terrestre. Par la suite, on a pu constater qu'ils avaient tort. Le cérium, le lanthane et le néodyme sont plus abondants sur la surface terrestre que le plomb. L'itrium est plus commun que l'étain et l'écorce terrestre est aussi riche en tulipes qu'en iodes.
L'histoire scientifique de ces éléments est très turbulente. La recherche de plusieurs années de dureté, de mélange et pas à pas après la connaissance accumulée à nos jours. Entre la première découverte d'un élément de cette famille et le dernier à isoler ont passé 144 ans. Il a fallu un demi-siècle pour découvrir que le dimium était un mélange de néodyme et de praséodyme.
La longue histoire de la recherche sur les terres rares est née en 1794. Cette année-là, le chimiste finlandais Johann Gadolin a isolé le premier oxyde de la famille des terres rares. Il a isolé la rouille d'une terre rare d'un minéral obtenu dans la municipalité suédoise d'Ytterby. Il croyait avoir un nouvel élément qu'il a baptisé comme itybita. Enfin, résumant, il a été appelé itria.
Des années plus tard, en 1803, des chercheurs comme Martin Heinrich Klaproth ou les célèbres Jöns Jacob Berzelius isolèrent à la fois une autre terre rare, également de la rouille. Il a reçu le nom de Zeria en l'honneur de l'astéroïde Zere nouvellement découvert. Ce fut aussi un élément pur. En 1808, Sir Humphry Davy a montré que les terres rares découvertes jusque-là n'étaient pas des éléments, mais des combinaisons entre les éléments métalliques et l'oxygène. Les métaux qui apportaient des oxydes de cerisier et d'itrie ont été appelés cérium et itrium.
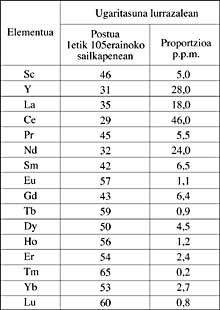
Pendant quarante ans, on considéra que l'itrie et le cerisier, c'est-à-dire celles qui étaient considérées comme des oxydes d'itrie et de cérium, étaient chimiquement bien définies. Mais ils étaient vraiment des mélanges d'oxydes de terres rares. En 1840, le minéralogiste suédois Carl Gustav Mosander obtint finalement la division de l'itrie et de la céramique en terres rares. Ce fut la découverte qui ouvrit la porte à la route vers l'isolement de toute la succession de terres rares.
Au cours des années suivantes, de nombreuses recherches ont été menées, mais on ne pouvait guère avancer. De grandes confusions ont été créées autour de certaines découvertes, et afin de clarifier si ces éléments étaient purs ou confusions, de nombreuses publications ont été faites. Les noms des éléments changeaient aussi de laboratoire en laboratoire.
En 1869, lorsque le chimiste russe Dimitri Ivanovitx Mendeleiev a proposé le tableau périodique, il a prévu la nécessité de laisser un trou pour le scandale. En 1871, il prévoit également quelques caractéristiques de cet élément. Lorsque, en 1879, il a découvert l'esquisse et ses caractéristiques ont été signalés à correspondre à ce qui était prévu par MendeleiEV. Ce fait a provoqué l'acceptation du tableau de Mendeleiev parmi les scientifiques.
Les recherches se poursuivirent durement, ce qui permit d'isoler le lutécio en 1907, dernier élément de la série.
Mais la vérité est que l'élément promise n'a pas été isolé jusqu'à beaucoup plus tard. Quand Henry Moseley a attribué à chaque élément du tableau périodique un numéro atomique, on a pu savoir exactement où se trouvaient les trous libres. Jusqu'aux années 1913-14 et Moseley découvrit que les lanthanides ne pouvaient être que 14 (du ciel à la lutécia) et que le numéro atomique 61 était le seul à être encore à découvrir. Cependant, il ne fut isolé qu'en 1947. Il a été appelé Prometio.
Pourquoi a-t-il été si difficile d'identifier et d'isoler ces éléments ? La raison peut être que ces éléments se trouvent dans un même minéral et présentent des caractéristiques chimiques très similaires. C'est pourquoi ils ont été cachés depuis si longtemps. Le plus lanthanide est le groupe d'éléments avec des caractéristiques similaires. En analysant un métal pur dans une découverte avec les nouvelles techniques développées dans les années à venir, à plus d'une occasion on a pu constater que c'était un mélange de deux ou trois terres rares.
Un avantage d'avoir des propriétés chimiques similaires est que, dans l'utilisation industrielle, lorsque ces propriétés doivent être exploitées, il ne vaut pas une distribution très fine. Cette distribution est nécessaire lorsque les caractéristiques à exploiter sont des caractéristiques physiques.
Structure électronique
Voici comment les électrons de ces éléments sont disposés. On sait que les électrons sont disposés en couches autour du noyau de l'atome. A chaque couche correspond un nombre quantique n et pour les lanthanides n = 6. Chaque couche a un certain nombre d'électrons et ceux-ci sont organisés à son tour en sous-couches. Ces sous-couches sont "s", "p", "d" et "f".
Comme le nombre atomique augmente, le nombre d'électrons augmente également. La structure électronique de l'élément précédent sera ajoutée un nouvel électron par lequel il est lié ci-dessous. L'électron ajouté ne sera pas placé n'importe où. Une série est formée par l'ensemble d'éléments correspondant au nombre d'électrons nécessaires jusqu'à compléter une sous-couche en formation.
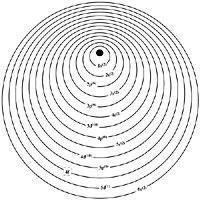
Les électrons les plus stables sont les électrons "s" et "p", donc ils ont tendance à se situer dans ces premières sous-couches. À la fin de la cinquième période du Tableau périodique, les sous-couches 4s, 4p, 4d et 5s et 5p sont complètes. La sixième période commence avec l'incorporation de deux 6s électrons et le troisième va à l'orbital 5d formant l'élément appelé lanthane. Le quatrième électron est dirigé à la sous-couche 4f, jusque-là vide. Étant donné que cette sous-couche a une capacité de 14 électrons, la série est composée de 14 lanthanides, du zéro au lutécio.
L'itrium et le scan qui forment la famille des terres rares se trouvent dans la même colonne du tableau périodique dans lequel se trouve le lanthane. Les électrons les plus superficiels du scanner sont deux électrons 4s et un électron 3d. Dans le cas de l'itrie, les électrons 5s et 4d.
Premières utilisations des terres rares
Le cérium a été le premier qui a gagné la renommée et la renommée parmi les terres rares et qui, dans une certaine mesure, a provoqué des recherches pour connaître toute la famille.
La découverte faite par le baron Auer von Welsbach en 1883 est à la base de l'intérêt suscité par le ciel. Le baron a publié cette année-là une nouvelle méthode d'éclairage. Welsbach mouillé un tissu en dissolution de sels de thorium, de cérium et d'autres terres rares. Il a ensuite découvert que le tissu donne la lumière brillante en le chauffant d'une flamme de gaz. C'était une découverte très surprenante pour cette époque. C'est une caractéristique qui est encore utilisé aujourd'hui, car il est le mode de fonctionnement de la chemise réfractaire des lampes à gaz du camping.
Quelques années plus tard, en 1903, Auer von Welsbach lui-même découvrit une autre utilisation de terres rares : la pierre de taille. Le cérium est un pyrophore, c.-à-d., il a la facilité de s'enflammer spontanément dans l'air et de tirer des étincelles en frottant. Le cérium a dû être allié avec du fer pour l'utiliser dans des pierres de portant, de sorte qu'il ne se nourrissait pas du feu. C'est la première étape qui a été faite pour utiliser des terres rares en métallurgie.
Une caractéristique commune à ces deux utilisations est qu'ils ne nécessitent pas d'éléments de grande pureté. Ainsi, ils ont pu être exploités industriellement à l'époque où les méthodes de distribution chimique pour ces usages n'étaient pas si développées.
Utilisations industrielles actuelles
Métallurgie métallurgie

Entre 1960 et 1974, un alliage appelé mischmetal, composé de lanthans, de cernes et de néodymes, a connu un essor spectaculaire dans les processus de fonderie et de purification de l'acier. En raison de l'affinité de cet alliage avec l'oxygène et le soufre, il est adapté à son utilisation comme désoxydant et désulfurant. Améliore les propriétés anticorrosives.
Dans la fonte, les matériaux sont plus résistants, ductiles et donc plus faciles à traiter.
Actuellement, il réduit l'utilisation de ce mischmetal en augmentant l'utilisation de composés de calcium dans la désulfurisation.
Réactions catalysées
Les terres rares sont très répandues dans des réactions chimiques comme la polymérisation ou l'hydrogénation, qui servent à accélérer ou modifier. Les lanthanides agissent rarement comme de véritables catalyseurs, leur rôle étant d'assurer la stabilité, l'activation et la sélectivité du système catalytique.
Dans le cracking du pétrole, par exemple, on utilise comme catalyseurs des structures cristallines appelées zéolites. Ils sont constitués de silicium et d'aluminium et d'éléments alcalins comme le potassium et le sodium. Le remplacement du sodium par un mélange de terres rares améliore les caractéristiques catalytiques et la vie effective de la zéolite.
Bateau catalytique de véhicules
Les catalyseurs sont utilisés dans le bateau catalytique pour stabiliser, optimiser son fonctionnement et prolonger sa vie. Les pots catalytiques sont obtenus en appliquant des composants actifs (platine, palladium et rhodium) dans une structure similaire aux cellules d'abeille formées d'aluminium et d'oxydes de cérium ou de lanthane. Dans les pays où la législation antipollution est la plus exigeante, l'utilisation du bateau catalytique est absolument nécessaire, ce qui signifie que des centaines de tonnes de terres rares annuelles sont nécessaires.
Verre et céramique
L'industrie du verre et de la céramique est l'un des plus grands consommateurs de terres rares. Les terres rares absorbent et émettent sélectivement plusieurs longueurs d'onde du spectre visible et ultraviolet. Les couleurs obtenues sont donc très claires, très définies et stables. Par conséquent, les terres rares sont utilisées comme colorants et même comme luminophores.
Bien que le contraire semble, les terres rares sont également utilisés pour obtenir du verre incolore. En ajoutant à un verre rouge une étrange terre qui absorbe sélectivement le rouge, on obtient un verre incolore qui rééquilibre le spectre des couleurs.
Les verres à terre rare supportent très bien la lumière du soleil, ils sont donc utilisés non seulement pour les fenêtres, mais aussi pour les lunettes de soleil.
Écran TV couleur
Comme mentionné précédemment, la première utilisation industrielle de l'oxyde de cérium a été le briquet de Welsbach, comme le disent Auer, ou d'autres. Nous savons que ce qui est en dessous de cette utilisation est une caractéristique qui devient luminescente avec la chaleur. Ce résultat était extrêmement surprenant à l'époque, d'où un grand intérêt pour les scientifiques et les non-scientifiques sur les terres rares. Mais il a fallu attendre les années 60 pour valoriser cette propriété physique.
D'ici là, nous allons garder à l'esprit que pour les années 60 les méthodes de distribution chimique étaient beaucoup plus développés et une télévision colorée est apparue. Les luminophores, c'est-à-dire les aspects sensibles du tube cathodique, en plus d'avoir une bonne luminosité et une longue durée, doivent donner une couleur très bien définie. Comme le vanadate d'itrium activé par l'Europe répond à ces exigences, il est utilisé sur les écrans TV couleur.
Ce sont les caractéristiques qui justifient l'utilisation de l'europium dans l'éclairage fluorescent.
Aimants permanents permanents
En 1969, les chercheurs ont découvert qu'avec l'introduction du samarium dans un alliage de cobalt, on obtenait un aimant durable extrêmement puissant. Cet aimant est très résistant à la démagnétisation et est 30 fois plus fort que les aimants traditionnels et six fois plus fort que les ferries (les meilleurs aimants de l'heure).
Avec les terres rares, on peut obtenir des aimants beaucoup plus petits qui ont la même force et on peut ainsi atteindre le Walkman du ditxoso, connu aujourd'hui. Les avantages offerts par les aimants de samarium et de cobalt sont si élevés qu'ils sont utilisés dans la plupart des électroaimants moteurs à basse et moyenne puissance, même si leur prix est très élevé.
Afin de surmonter la barrière des prix, d'autres recherches ont été menées et en 1983, il a été constaté que les aimants composés de ferbores et de néodyme ont les propriétés adéquates. De cette façon, vous pouvez éviter d'utiliser un métal aussi cher que le samarium. Ce nouveau matériau ne maintient pas ses caractéristiques au-dessus de 300ºC (tandis que le samarium-cobalt les maintient jusqu'à 700ºC), ce qui rend difficile son utilisation pour certaines fonctions comme les moteurs de démarrage des véhicules.
Par supraconductivité

La supraconductivité consiste en la disparition de la résistance électrique et donc de la dissipation énergétique. Beaucoup de matériaux présentent cette propriété près du zéro absolu (-273ºC).
Dans les études de ces dernières années, des matériaux ont été trouvés présentant cette propriété à des températures supérieures. En 1986, un oxyde de lanthane, de baryum et de cuivre a été retrouvé superchauffeur à -243ºC. A. Müller et J.G. Les physiciens allemands Bednorz. Pour ce travail, ils ont reçu le prix Nobel et ont ouvert une nouvelle étape dans le domaine de la supraconductivité à des températures plus élevées.
Les nouvelles études ont porté la limite jusqu'à -183ºC avec des oxydes ternaires avec des terres rares. Aujourd'hui, le record a atteint les -148ºC et personne ne sait à quel point les chercheurs pourront porter cette limitation dans les années à venir.
Les utilisations mentionnées ne ferment pas la liste. La radiologie, les lasers, l'optique de réglage et les bijoux sont des domaines qui exploitent les propriétés des terres rares.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia