Gilbert Newton Lewis kimikaria: garai baten adierazle
1986/04/01 Iturbe, J. Iturria: Elhuyar aldizkaria

Gilbert Newton Lewis Massachusetts-en jaio zen, 1875.eko Urriaren 25ean, baina artean ume, bere familiak Lincoln-a, Nebraska-ra, emigratu zuen. Bere gurasoak izan ziren lehendabizi Unibertsitatera iritsi zirenak, familian. Bere aitak (abokatua) eta amak (andareñoentzako ikastetxe batean hezia) maila kultural ertaina baino altuago zuten, eta heziketa-sistemaz desados, ez zituzten beren seme-alabak eskolara eraman ia Unibertsitatera joateko adina izan zuten arte. Gauza bera egingo zuen Lewis-ek ere.
Ez dago argi zerk bultzatu zuen Gilbert N. Lewis Zientziaren eremura, eta, Nebraska-ko Unibertsitatean urte pare bat igaro ondoren, 1894.ean Harvard era sartu zen, graduatu-gai bezala lan eginaz. Bertan, T. W. Richards profesorearekin egin zuen lan; 1914.ean Nobel Saria irabaziko zuenarekin. Berarekin Termodinamikaren eta teknika esperimentalen maisu izatera iritsi zen, 1899.ean Doktoretza lortuz.
1904 ean Filipina irletan urtebete eman zuen, eta 1905.ean Massachusetts Institute of Technology-ra ( MIT ) ikertzaile-laguntzaile bezala lan egitera joan zen, A A. Noyes-ek deitua. Azken hau, Richards bezala, Ostwald-ekin ikasia zen Europan, eta MIT ko Kimika Fisikoko Ikerketa-laborategia muntatzen ari zen, irakaskuntz lanik ez zuten ikertzaile post-doktoralez osatutako talde batekin.
Zazpi urte oparo igaro ondoren, 1912.ean Berkeley-ko California-ko Unibertsitateko Kimika-Saileko Buru eta Dekano izendatu zuten. Lehen Gerran, Frantzian igaro zuen urtebete, gerra kimikoaren Defentsa-Saileko buru bezala. Tarte horretan izan ezik, Berkeley-n segitu zuen erretiratu arte, eta gero, emerito bezala 1946.eko Martxoaren 23an bihotzeko batez laborategian hil zen. Lan-postu horretan praktikara eramango zituen bere ikerkuntza eta irakaskuntzazko ideiak, eta ondorioak azaltzen saiatuko naiz ondoko lerroetan.
LEWIS, IKERTZAILE
Lewis-ek, ikertzaile bezala, bizitza oso oparoa izan zuen. Zaila da ukitu zituen arlo guztiez behar den bezala hitz egitea, eta hemen lau arlo nagusitako Lewis-en kontribuzioak aurkeztuko dira, nahiz eta konsziente izan honelako banaketa batek Lewis-en benetako irudia zerbait aldatuko duela, eta gauza asko alboan utziko dituela; ez bait zen eremu estankoetan eta mugatuetan aritzen.
Lotura, azido-base teoria (1916)
Behar bada, hau izango da teoriarik ezagunena eta Lewis-en izena gehien hedatu duena. Teoria honen garrantzia ongi ulertzeko, noiz postulatu zen kontutan hartu behar da, eta urte haietan egitura atomikoaz eta molekularraz nagusi ziren ideiak ere bai.
Teoria atomikoarekin batera hasi ziren atomoak elkarrekin lotzen dituzten indarren izaerari buruzko teoriak. Lotura honen izaera argi zegoen, zeren erreakzio kimiko batez elektrizitatea sortzen bait zen (Volta-ren pila), eta korronte elektriko batez substantziak deskonposatzen bait ziren (elektrolisia). Berzelius-ek zera postulatu zuen: atomoak, karga edo polo desberdinez osotuta zeudela, eta konposatuak, karga horien neutralizazioz sortuko liratekeela.
Teoria horrek ondo azalduko luke zenbait kasu, baina denbora igaro ahala problemak agertuko zituen. Alde batetik, eta substantzia puru baten molekula poliatomiko homonuklearren existentzia onartu zenean, nola azaldu atomo berdinen artean gertatzen den lotura? Bestetik, eta hau garrantzitsuago zen, Kimika Organikoaren arloan aurrerakada handia izan zen, eta hasieratik argi zegoen karbono-karbono loturaren rol garrantzitsua. Baina nola elkar daitezke elektrikoki berdinak diren atomoak?
Honela aritu ziren kimikariak, teoria orokor baten faltan, nahiz eta 1897.ean Thomson-en elektroiaren aurkikuntzak, ideia berriak sortu. Thomson-ek berak loturaren "teoria positibo-negatibo" delakoa proposatu zuen. Bertan, lotura, karga desberdinen arteko erakarpena baizik ez da. Molekuletan atomo batzuk neutroak izateko baino gehiago dituzte, eta besteak gutxiago. Teoriak oso ondo azaltzen zituen konposatu ezorganiko edo polarrak; adibidez, sodio kloruroa, honela irudika daitekeena:
-C1 - Na +
Baina problemak berdin zirauen molekuletan edo konposatu organikoetan. Adibidez, hidroge no kloruroa; kloroa, goiko adibidean bezala, negatiboki kargatzen bada, honela errepresenta daiteke: -C1--H + , eta berdin jarraituz, metanoa eta karbono tetrakloruroa,
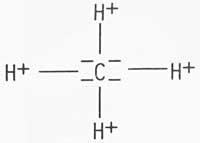
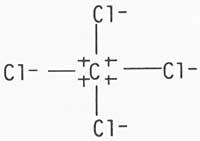
Honela, karbonoa, batzutan positiboki eta bestetan negatiboki kargatuko da. Hau azaldu nahiean, H. Fry-ek "elektromeroen" existentzia postulatu zuen, atomo batek konposatu berean karga desberdinak izatea posible delarik; adibidez, + H--C1- eta - H-- Cl +
Luze aritu ziren kimikariak karbono tetranegatibo edo tetra-positiboaren atomoak konposatu organikoetatik isolatu nahiean (besteak beste, W.A. Noyes, Lewis-en irakaslea MIT-en).
Lewis-ek 1916.ean bere loturaren teoria postulatu zuen. Teoria honen arabera, kargak ez dira zeharo transferitzen atomo batetik bestera, baizik eta elektroi-bikote baten transferentzia ez-osoa gertatzen da, eta elektroi bakoitza atomo bakotzetik ateratzen da. horrela, atomo biek elektroi-bikotea konpartitzen dute, atomoen nukleoak elkartuta mantentzen dira, eta ezin daiteke esan bikotea atomo batena edo bestearena denik. Horrela, ez dira ioi positiboak edo negatiboak sortzen. Konposatu ez-polarretan, organikoetan nagusiki, erraz ikusten da teoria hau:
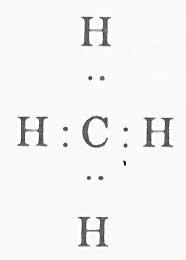
baina polarretan ere aplika daiteke.
Adibidez, hidrogeno kloruroaren kasua, kontrako karga desberdinez lotutako ioiak izan beharrean, atomo bien arteko elektroi-bikote bat egotea posible da, H:CI, eta kloroaren elektronegatibitate altuagoz, elektroiak klororantzago egotea, honek elektroiak gehiago konpartituz. Mugan, elektroi biak kloroaren gainean egongo dira, eta lotura ioniko hutsa izango da; beraz, aurreko karga desberdinen teoria, Lewis-en teoriaren muga baizik ez da.
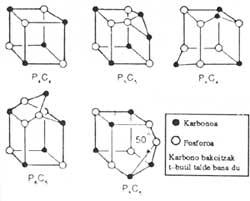
Zerk bultzatu zuen Lewis teoria hori aurkeztera? Ordurarte gauza jakina zen konposatu gehienek elektroi-kopuru bikoitia dutela, eta bestalde, konposatuen estabilizaziorako, elektroi-zortzikotearen garrantzia ere bai. Le wis-ek lotura kimikoa bakarra zela pentsatzen zuen, hots, ez zegoela lotura-mota bat konposatu ionikoentzat eta beste bat organikoentzat (naturaren izaeraz ikuspuntu emankorra, berau). Orduko atomoaren ereduen artean (Thomson, Bohr, Rutherford,...) eredu ez-ezagun bat aukeratu zuen bere teoriarako; atomo kubikoaren eredua.
Bertan, atomoa kubikoa da, eta kuboaren erpinetan elektroiak kokatzen dira. Elektroi-zortzikoteak atomoari egonkortasuna emango lioke, eta hori lortzeko elektroiak beste atomoekin konpartitzen saiatuko litzateke.
Eredua eskasa zen (hidrogenoaren kasua, elementu astunak, lotura hirukoitzaren kasua), baina elektroien konpartitzearen ideiari bide eman zion. 1916.eko artikuluan, eredua baztertuta agertzen da jadanik, elektroi-bikotearen ereduak, atomoaren eredu kubikoaren premiarik behar ez duelarik.
Loturaren ideia honek konposatu askoren egituraz argitasuna eman zuen, hala nola oxiazidoen kasuan edo amonio ioiaren kasuan (ordurarteko teoriez azaldu ezinak ziren) eta gainera, aurkitu berri ziren konposatu batzurena aurresateko balio zuen (hidruro metalikoak, alegia).
Teoria honen erraztasunak eta aplikagarritasun orokorrak egin zuten 10 urte baino gutxiagotan generalki onartua izatea, bai kimika organikoan eta bai ezorganikoan. Loturaren teoria honetaz, adibidez, erreakzio organikoen mekanismoak, askoz errazago azaltzen ziren, eta era berean kolorea, hidrogeno-lotura, likidoen asoziazioa, eta abar.

Loturaren ideia orokorrean, eta ondorio bezala, atal bat azido eta baseentzat zegoen. Honen arabera, azido elektroi-bikote bat onar dezakeen edozein substantzia litzateke, eta base, eman dezakeena. Neutralizazioa, lotura osotzea.
Galdera bat egin daiteke orain; zergatik formatzen dira bikoteok? Lewis-entzat, elektroiak parekatu egiten dira jatorri magnetikozko indarrez. Hau elektroiaren spinaren iragarpena izan zitekeen. Baina Heisenberg-ek eta Dirac-ek molekula baten barruko elektroien arteko elkarrakzioak erresonantzi edo truke-efektu batetatik datozela frogatu zuten independenteki, eta 1927.ean Heitler-ek eta London-ek hidrogeno-molekularen elektroi-bikotearen energia kalkulatu zuten.
1928.ean argi geratu zen elektroi-bikotea Mekanika Kuantikoaren printzipioetatik ondoriozta daitekeela, eta Lewis-en teoriari funts teorikoa eta kuantitatiboa eman diezaizkiokeela. Hala ere, Mekanika Kuantikoaren zailtasun matematikoak direla eta, Lewis-en teoria era kualitatiboz erabilpen orokorrekoa da Kimikaren adar guztietan.
Termodinamika
Mende honen hasieran, hots, Lewis Termodinamikaz ikertzen hasi zenean, Zientzia honen egoera ez zen hoberena. Alde batetik, Printzipioak argi eta onartuta zeuden (hirugarrena izan ezik). Bestetik, Kimikariengan zuen eragina txikia zen, eta aplikatzeko momentuan, puntualki, eta sarritan desegoki, aplikatzen zen.
Premiazko izango zen Kimikarientzako, aplikazioa errazten zuten erlazio orokorrak aurkitzea eta hedatzea. Eta hori egin zuen Lewis-ek, 1923.ean M. Randall-ekin "Thermodynamics and the Free Energy of Chemical Substances" delako liburua atera zuen, eta hau, oraindik bere hartan, testu-liburu bezala erabiltzen da.
Lewis-en lehendabiziko aportazioa, fugazitatearen eta aktibitatearen kontzpetuen proposapena izan zen.
Bigarren aportazioa, Termodinamikaren hirugarren legeak kimikarientzat duen garrantziaz jabetzea izan zen. Hortik, tenperatura baxuetan eginiko neurketen kopurua eta bere ikasle zen W.F. Giauque-ren (1949.eko Ki mikako Nobel Saria) termodinamika estatistikoan agertuko ziren.
Hirugarren aportazioa, elektrolito sendoen arazoa zen. Mendearen hasieran arazo hau nahasia zen. Elektrolito ahulen kasuan, Ostwald-en diluzio-legea nahikoa zen, baina diluzio kontzentratuetan eta maila handian disoziaturiko elektrolitoen kasuan, huts egiten du; adibidez, elektrolito sendoei Ostwald-en ideiak aplikatzen badizkiogu, eta disoziatu-ezdisoziatu oreka bat lortu dela suposatzen badugu, disoziaturiko frakzioa bai konduktantziaz, bai izozte-puntuaren beherapenaz determina daiteke; horrela eginez, diferentziak oso handiak dira; teoria gaitzesteko adinakoak.

Problema gainditzeko, zenbait taldek lan egiten zuen bai teorikoki eta bai praktikoki. Azken hauen artean, Bronsted (Danimarkan) eta Lewis (Californian). Lewis eta Linhart-ek izozte-puntuaren beherapenak ekuazio enpiriko batez erlazionatu zituzten 1919.ean, eta datu berriak lortzeko diseinatutako sistemak oraindik hoberenen artean aurkitzen dira.
Lewis-en jatorrizko aportazioak ugari ziren, baina aipatu nahi nuke ikerketa-estiloa ere. Richards-ekin ikasitako arta eta metodoa neurketa esperimental guztietara eraman zituen, balio esperimental zehatzen garrantzia azpimarratuz; eta baita gaiak azaltzeko zituen erraztasuna eta elegantzia ere, bere ideiak 60 urte geroago berak planteatuta bezala erabiltzeko moduan utzi zituelarik.
Isotopoak
Badirudi kimikariarentzat nukleo atomikoak ez lukeela garrantzi handirik izan behar, baina badago zenbait fenomeno non nukleoaren propietateek paper handia jokatzen duten (erresonantzia nuklear magnetikoa, eta simetri zentrua duten molekulen espektroskopian, adibidez). Kasu hauetan, isotopoek eman dezaketen informazioa funtsezkoa da, eta horretaz interesatutako kimikariek isotopoez zerbait jakin behar dute.
Isotopoen existentzia Soddy-k 1911.ean frogatu zuen, eta Fajans-ek esan zuen isotopo desberdinen propietate termodinamikoak desberdinak izan beharko zutela. Adibidez, Lindemann-ek kalkulatu zuen, 206 pb eta 208 pb isotopoen artean %0'002ko diferentzia egongo zela bapore-presioan. 20.eko hamarkadan, elementu arinen isotopo-multzo handia deskubritu zen, batez ere espektroskopikoki ( 18 0, 17 0, 13 C, 15 N, D,...).
Isotopo konkretuan aberats ziren substantzien lorpena izan zen urte haietako problema nagusi bat. 1931.ean Lewis hasi zen problema horretaz arduratzen, eta isotopoak kimikoki bereizten aritu zen, helburuak, batez ere, 6 Li eta 18 0 zirelarik. Gaur egun, gauza ezaguna da lagin bat bi isotopoz aberastea zailentarikoa dela, eta arrakasta ez zen handiegia.
Hala ere, litioaren kasurako, lortu egin zuen, aurreko urteetan alkalien elektrodo-potentzial standardak ur-disoluziotan determinatzeko asmatutako sistema batez. Horretarako 10 litro litio-amalgama erabili zituen, 18 metroko altuera zuen kontrakorronteko zutabe batetan. Lortutako emaitza zera zen, 6 Li delakoa amalgaman kontzentratuz,

Baina aberastea ez zen nahikoa. Isotopo konkretua soilik duten substantziak behar dira isolatu, adibidez, D 2 0 edo ur astunaren propietateak determinatzeko, %99 D duen ura behar da. Eta hori lortzeko Lewis-ek hiru metodo aztertu zituen: uraren elektrolisia, gero gramotako kantitateak lortzeko industrialki ere erabiliko zena; difusioaren metodoa, hidrogeno-gasa burdinan zehar 500-800 K-etan pasa eraziz, baina oraingoan emaitzak negatiboak ziren; eta hirugarrena, uraren distilazio frakzionatua, honela aberastua lortzen delarik, nahiz eta ez purutasuna. Horrela, Lewis-ek ur astuneko laginak prestatu zituen, eta bere laborategian erabiltzekoa bereiztu ondoren, beste ikertzaileei banatuko zien. Zenbaitzu Lawrence-ri eman zizkion, honek bonbardaketa nuklearretan erabil zitzan.
Adibide bezala,
12 6 C 2 1 (H, 1 0 n) 13 7 N
erreakzioa aipa daiteke, zeinean nitrogenoaren isotopo ezegonkorra (erdi-bizitza, 10 min) lortzen baita. Erreakzioa gertatu deneko helburuak aztertu baziren, eta 13 7 N-a detektatu, erradioaktibitate artifiziala aurkitua izango zen...
Ur astunaren gramoerdi inguruko kantitatezko laginekin, eta semi-mikro deritzon teknika analitikoekin, substantzia horren propietate fisikoak (irakite-puntua, izozte-puntua, bapore-presioa, dentsitatea,...) determinatu zituen, eta landareetan eta animalietan daukan eragin kaltegarria ere egiaztatu zuen. Halaber, zerak neurtu zituen, azidoen disoziazio-konstanteak ur astunetan, konposatu deuteratuen propietate fisikoak, erreaktibitate kimikoa ur astunetan, ur astunaren konstante dielektrikoa eta errefrakzio-indizea, puntu hirukoitza,...

Guztitara, deuterioaz eta bere konposatuen propietateez 26 ikerketa-artikulu argitaratu zituen 15 hilabetetan ( 1 933.eko Otsaila - 1934.eko Urtarrila). Bitartean, bere departamentuan deuterioaz beste propietate zenbait aztertzen ziren: gas-erreakzioak, efektu isotopikoak zinetiketetan, espektroskopia bibrazionala,... Laburki esanik, isotopoen aplikazio- eta ikerketa-eremuak ireki eta landu zituen, gaur egun hain garrantzitsu diren isotopoen kimika eta fisika aitzineratuz.
Triplete egoera
Lewis-en bizitzan zehar zenbait ideia finko zeuden, eta bata substantzien kolorearen zergatikoa zen. 1902.etik hasita, behin eta berriz galdetzen omen zuen zergatik den zerbait koloreztatua, zerk sortzen duen kolorea. Loturaren teoriak bideak ireki zituen, trantsizio elektronikoetan elektroi-bikoteek zer eginkizun duten bideratuz. 1939.ean, review-artikulu bat argitaratu zuen substantzia organikoen koloreaz.
Gauza jakina zen orduan. koloratzaile guztiek ez dutela fluoreszentziarik ematen. Fenomeno hori azaltzeko, Lewis-ek molekulek egoera eszitatuetan posible dutela soberan duten energia bai argi bezala zuzenik emititzea (fluoreszentzia), bai maila energetiko errotazional-bibrazionaletara pasatzea (energiaren galera bero bezala) proposatu zuen. Horrela bada, energi galera hau txikiagotu egin daiteke molekula ingurune zurrun batetan jarriz, zeinean ezin bait du ez biratu eta ez errotatu. Orduan, argia emititu behar du.
Proposamen hau praktikara eraman zuen, nitrogeno likidoaren tenperaturatan molekula guztiek fluoreszentzia ematen dutelarik, baina argi eszitatzailea itzaltzen denean ere, fosforeszentzia agertzen dela ikusi zen. Fosforeszentziaren jatorria ez zegoen argi une hartan. Trantsizio elektronikoen selekzio-arauen kausaz, fosforeszentzia ematen duen goi-maila eszitatua, oinarrizko egoeraren multiplizitate berdinekoa dela pentsatzen zen, eta fosforeszentzia den emisio atzeratua, maila metaegonkor batetatik zetorrela, hain tenperatura baxuetan, eta egoera solidoan gerta zitezkeen maila energetiko metaegonkor batetatik, hain zuzen.
Beste aldetik, molekulen egoera tripleteak zeuden; orbital molekularraren teoriatik ondorioztatzen direnak. Lewis 1942, etik urrera saiatu zen –eta lortu egin zuen– fosforeszentziako goi-maila tripletea dela frogatzen, eta ez maila singlete metaegonkorra. orretarako, lehendabizi, ia laurogeitamar molekulen fosforeszentzia espektro lortu zituen, substantzia desberdinetan disolbatuz eta, hoztuz (kristalizatuz). Horrela, fosforeszentziaren orokortasuna eta ingurunearekiko independentzia frogatu zuen. Orduan proposatu zuen fosforeszentzia triplete maila batetik sortako argia zela.
Lewis-en kuriositatea orokorra zen, eta dena interesatzen zitzaion. Berarenak dira hitz hauek: "Physical Chemistry is anything that is interesting", hots, "Kimika Fisikoa, interesgarri den edozer gauza da", eta Zientziaren alor guztiak landu zituen bere bizitzan. Erlatibitatea, elektrokimika, espektroskopia, eta beste zenbait alor aipa daiteke, baina esandakoa nahikoa dela uste dut. Detaile bezala zera esango dut: bera izan zela "fotoi" hitza zientziarako sortu zuena.
Hori frogatzeko, esperientzia definitiboa diseinatu zuen. Egoera eszitatu hori tripletea dela segurtatzeko, egoera tripletearen paramagnetismoaz baliatu zen. Esperimentua martxan jartzen zegoenean hil zen, eta bere kolaboratzaile zen Michael Kasha-k bukatu zuen arrakasta osoz. Oso denbora gutxi barru, egoera tripletean fosforeszentziak duen eginkizuna, komunitate zientifikoan ez zen zalantzan jartzen, eta denbora pasatuta, beste gauzarik pentsa zitekeenik ere ez da asmatzen. Hau izango da Kimikaren historia laburrean, esperimentu gogoangarrietako bat.
Eta beste

Lewis-en kuriositatea orokorra zen, eta dena interesatzen zitzaion. Berarenak dira hitz hauek: "Physical Chemistry is anything that is interesting", hots, "Kimika Fisikoa, interesgarri den edozer gauza da", eta Zientziaren alor guztiak landu zituen bere bizitzan. Erlatibitatea, elektrokimika, espektros kopia, eta beste zenbait alor aipa daiteke, baina esandakoa nahikoa dela uste dut. Detaile bezala zera esango dut: bera izan zela "fotoi" hitza zientziarako sortu zuena.
LEWIS, IRAKASLE
Lewis-en alderdi ikertzailea garrantzitsua den arren, irakasle bezala zuen alderdia ez zen garrantzi txikiagokoa; Bekerley-n, Californian, 1912.etik 1940.era Kimikako Departamentuko buru izan zen artean batez ere. Bere ikasleen artean, zenbait Nobel saridun daude (Urey, 1933; Giauque, 1949; Seaborg, 1951, Libby, 1960; Calvin, 1961). Honen aurrean, Lewis-ek irakaskuntz sistema propioa garatu zuela, eta eskola sortu zuela, eta eskola horren ondorioak hor daudela esan daiteke.
Lewis-ek e zuen idatzi irakaskuntza unibertsitarioaz inolako trataturik. Bere ideiak praktikara eramatea bakarrik egin zuen, eta praktika horretatik atera daiteke bere pentsamoldea. Hemen zenbait puntu, behar bada deigarrienak, aipatu baino ez ditugu egingo.
Lehenik eta behin, Lewis-ek Kimikako departamentu barruan zientzia irakatsi eta aurrera eraman behar zela pentsatzen zuen. Baina oinarrizko printzipioen ikasketa egin behar zen, eta ez aplikazio industriala ukan zezaketen arloak landu. Hala ere, Kimika aplikatuarekin egon behar duen orekak, kasuan kasuko herrien eta unibertsitateen araberakoa izango da. Mende honen hasierako Californiako Unibertsitatea horrelako teorizale baten eskutan egotea oso aberasgarri izan zen epe luzera, nahiz eta laburrera, denbora- eta diru-galtzea iruditu.
Bigarrenik, Lewis-entzat kimikariak, goi-inteligentzia behar zuen. Horregatik bere departamentuan, ikasle arruntekin saiatu ordez ikaslerik aurreratuenak hartzen zituen Unibertsitateko lehen kurtsoaz gero ikasleak bereiztu egiten zituen eta graduazio hutsa nahi zutenek, irakaskuntza standarda jasotzen zuten, baina ikasle azkar eta gogotsuak agertzen baziren, talde txikitan heziketa berezia izaten zuten. Beraz azken urteetako ikasleen edo doktore-gaien eskutik, ikasle berrien abileziaz oso goiz probetxatzen zen.
Hirugarren ezaugarria, zera zen, Kimika ez zela datuen biltegia edo jakinduri pilaketa. Aldiz, bere Fakultatean, Kimikazko curriculum-a minimoa zen; oinarrizko printzipioetara "mugatua", eta nor bere gogo edo espezialitateen arabera printzipioak aplikatzeko gai izatera zuzendua. Horregatik, termodinamika gai nagusi zen, baina petrolio-kimikarik ez zen irakasten. Honek, ikaslea pentsatzera bultzatzen zuen, eta gainera, Lewis-ek eztabaida irekiak promozionatzen zituen (batez ere ikasle eta ikertzaile gazteen artean) eztabaida horiek denentzat positiboak zirelarik.
Ez da harritzekoa, beraz, Lewis-ek eztabaida irekiak promozionatzea (batez ere ikasle eta ikertzaile gazteen artean) eztabaida horiek denentzat positiboak zirelarik.

Laugarren ezaugarria, bere graduatuekin zeraman jarrera izan daiteke. Printzipioz, askata sun osoa emanez, laborategi-gelak eta biltegiak irekiak ziren. Lewis dekano izanik, erraztasun burokratiko guztiak zituzten; baina harremana ere egunerokoa zen bere ikasle hauekin. Azterketa ugari ere egiten zuen, Doktoratze-azterketa finalak eta orokorrak baztertuz. Honek lan handia exigitzen zien doktore-gai guztieti, eta bere eskuetatik pasatako ikasle guztiek esaten dute hamabi orduko lanegunak eta zazpi eguneko lanarteak arruntak zirela, eta erritmo hori zenbait urtetan zehar luzatzen zen, nahiz eta normalki berak egin zezakeena edo egiten zuena baizik ez eskatu.
AZKEN HITZA
Lewis-en irudia bukatzeko, Kimika Fisikoaren historian horrenbeste ekarpen berri egin duenik gutxi izango dela esan behar da. Bere bizitzan zehar ezaguna izan zen arren, Nobel saria jasotzearen pozik ez zuen izan, nahiz eta merituak ugari izan. Baina Lewis-en giza, ikertzaile- eta irakasle-irudia ezagunagoa izan dadin, merezi zuen, idazlan hau egiteak.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia