O reto dos novos medicamentos biosimilares
2014/11/01 Calvo Hernáez, Begoña - Farmazian eta Farmazia Teknologian katedradunaFarmazia Faktultatea. EHU Iturria: Elhuyar aldizkaria
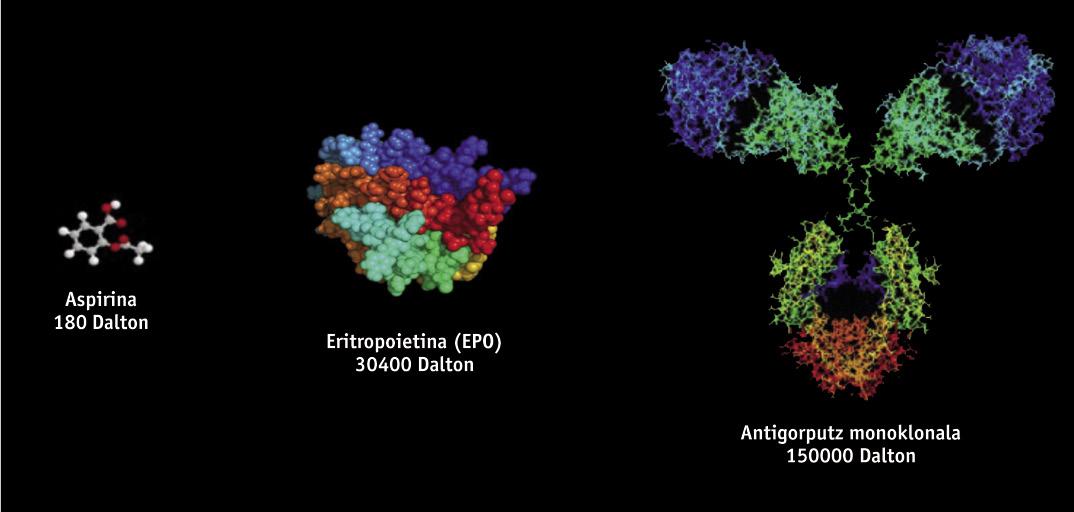
Os medicamentos biotecnológicos, de estrutura proteica, obtéñense mediante técnicas de enxeñaría xenética, como o ADN recombinante, polo que é moi difícil o seu estudo e caracterización, a diferenza dos medicamentos xenéricos que se obteñen mediante síntese química. Os medicamentos biotecnológicos obtéñense a partir de organismos vivos modificados xeneticamente, como bacterias, fermentos e certas liñas celulares de orixe animal e vexetal. Dado que na fabricación utilízanse diferentes liñas celulares e procesos produtivos, non existen dous produtos de orixe biolóxica totalmente iguais. Por iso, dado que as copias de medicamentos orixinais son similares pero non exactamente iguais, a normativa de xenéricos non é cientificamente adecuada paira os biosimilares. Pequenas variacións da molécula ou pequenas modificacións no proceso de fabricación poden afectar o resultado e ao produto final, polo que a súa fabricación necesita dunha normativa específica.
Estímase que os medicamentos biosimilares son un 20% máis baratos que os produtos orixinais, obténdose un menor aforro que os xenéricos, polo que son un 40% máis baratos que os orixinais. No entanto, a pesar de que a porcentaxe de aforro é menor, debido a que se utilizan en terapias custosas, a súa introdución na práctica clínica suporá una gran vantaxe paira o sistema sanitario e permitirá aos pacientes acceder a terapias custosas.
Por outra banda, a entrada dos biosimilares no mercado supón un aumento da competencia, o que loxicamente redundará nunha diminución do prezo deste tipo de produtos. Desta forma, os orzamentos sanitarios serán máis sustentables e poderanse destinar recursos como o apoio a liñas de investigación sanitaria paira outros fins.
Biosimilares en Europa
Entre os medicamentos biosimilares aprobados até o momento en Europa atópanse produtos como a hormona do crecemento, a eritropoyetina (EPO) ou a interferona. Recentemente, ademais, aprobáronse os primeiros biosimilares de anticorpos monoclonales, como a infliximaba, que se utiliza paira o tratamento de enfermidades autoinmunes (enfermidades reumatológicas, psoriásicas, enfermidades de Crohn, entre outras). Os anticorpos monoclonales son moléculas aínda máis complexas que os biosimilares iniciais, e é de supor que terán una "enorme influencia". Estímase que até o ano 2020 poderíanse aforrar vinte mil millóns de euros utilizando anticorpos monoclonales biosimilares.
En España, a implantación de biosimilares admitidos non é a mesma en todos os casos: algunhas biosimilares conseguiron una implantación do 50% (como a filgrastima, que se utiliza paira combater a diminución da defensa dos pacientes oncolóxicos tratados con quimioterapia), outras conseguiron una implantación menor: por exemplo, as eritropoyetinas conseguiron una implantación do 20% aproximadamente e as hormonas do crecemento da orde do 5%.
Os biosimilares acéptanse na nosa contorna a través dun procedemento centralizado en Europa. A Axencia Europea de Medicamentos (EMA, polas súas siglas en inglés) é a encargada de definir os requisitos que deben cumprir estes produtos paira a súa comercialización na Unión Europea. Tras a publicación en 2004 do marco legal sobre biosimilares por parte da SEM, editáronse una serie de guías e normas sobre requisitos de calidade, tantos xenerais como específicos paira cada produto, así como de ensaios preclínicos e clínicos previos á aprobación dos produtos. A EMA foi pioneira no mundo en establecer este tipo de normativas paira a autorización de biosimilares. De feito, outras rexións e países desenvolvidos baseáronse na normativa europea paira publicar os seus regulamentos: Australia, Xapón, etc. O mesmo ocorre coas directrices marcadas pola Organización Mundial da Saúde (OMS) e a Axencia de Alimentos e Medicamentos de Estados Unidos (esta última organización está en fase de aprobación das primeiras instrucións sobre biosimilares).
Por último, a aparición destas copias de medicamentos biolóxicos, do mesmo xeito que a aparición dos xenéricos, xerou un debate ao redor das posibilidades de garantir a mesma calidade, eficacia e seguridade que os medicamentos de orixe. Os médicos encargados de prescribir este tipo de fármacos deben saber que os biosimilares non conseguen autorización se non se demostra que son comparables aos produtos orixinais. Paira iso, a SEM establece estritos controis e requirimentos. Por tanto, é fundamental que o persoal sanitario que prescribe e utiliza este tipo de fármacos dispoña de información científica, precisa e sólida sobre as peculiaridades destes tratamentos.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia




