El repte dels nous medicaments biosimilares
2014/11/01 Calvo Hernáez, Begoña - Farmazian eta Farmazia Teknologian katedradunaFarmazia Faktultatea. EHU Iturria: Elhuyar aldizkaria
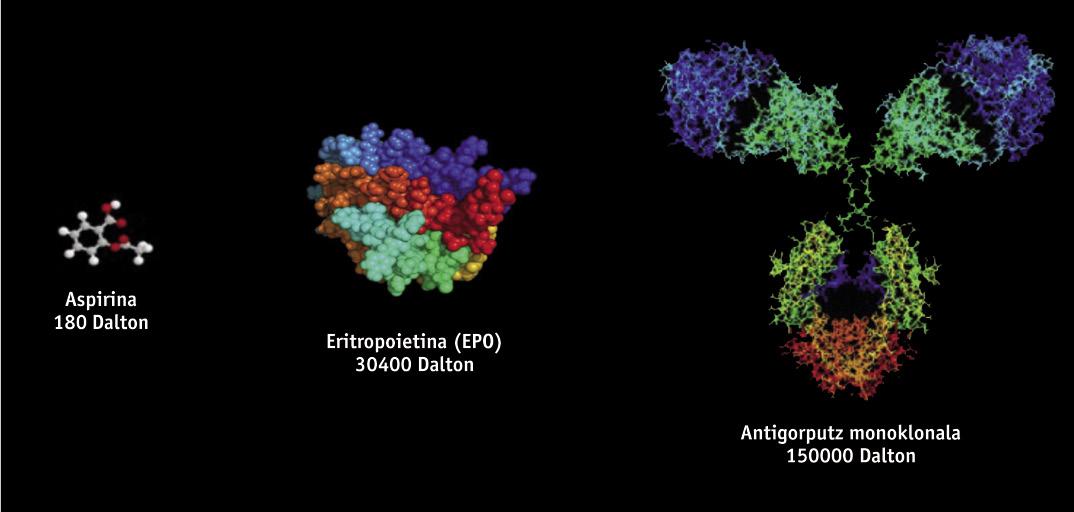
Els medicaments biotecnològics, d'estructura proteica, s'obtenen mitjançant tècniques d'enginyeria genètica, com l'ADN recombinant, per la qual cosa és molt difícil el seu estudi i caracterització, a diferència dels medicaments genèrics que s'obtenen mitjançant síntesi química. Els medicaments biotecnològics s'obtenen a partir d'organismes vius modificats genèticament, com a bacteris, llevats i certes línies cel·lulars d'origen animal i vegetal. Atès que en la fabricació s'utilitzen diferents línies cel·lulars i processos productius, no existeixen dos productes d'origen biològic totalment iguals. Per això, atès que les còpies de medicaments originals són similars però no exactament iguals, la normativa de genèrics no és científicament adequada per als biosimilares. Petites variacions de la molècula o petites modificacions en el procés de fabricació poden afectar el resultat i al producte final, per la qual cosa la seva fabricació necessita d'una normativa específica.
S'estima que els medicaments biosimilares són un 20% més barats que els productes originals, obtenint-se un menor estalvio que els genèrics, per la qual cosa són un 40% més barats que els originals. No obstant això, a pesar que el percentatge d'estalvi és menor, pel fet que s'utilitzen en teràpies costoses, la seva introducció en la pràctica clínica suposarà un gran avantatge per al sistema sanitari i permetrà als pacients accedir a teràpies costoses.
D'altra banda, l'entrada dels biosimilares en el mercat suposa un augment de la competència, la qual cosa lògicament redundarà en una disminució del preu d'aquesta mena de productes. D'aquesta forma, els pressupostos sanitaris seran més sostenibles i es podran destinar recursos com el suport a línies de recerca sanitària per a altres finalitats.
Biosimilares a Europa
Entre els medicaments biosimilares aprovats fins al moment a Europa es troben productes com l'hormona del creixement, l'eritropoetina (EPO) o la interferona. Recentment, a més, s'han aprovat els primers biosimilares d'anticossos monoclonals, com la infliximaba, que s'utilitza per al tractament de malalties autoimmunes (malalties reumatológicas, psoriásicas, malalties de Crohn, entre altres). Els anticossos monoclonals són molècules encara més complexes que els biosimilares inicials, i és de suposar que tindran una "enorme influència". S'estima que fins a l'any 2020 es podrien estalviar vint mil milions d'euros utilitzant anticossos monoclonals biosimilares.
A Espanya, la implantació de biosimilares admesos no és la mateixa en tots els casos: algunes biosimilares han aconseguit una implantació del 50% (com la filgrastima, que s'utilitza per a combatre la disminució de la defensa dels pacients oncològics tractats amb quimioteràpia), unes altres han aconseguit una implantació menor: per exemple, les eritropoetines han aconseguit una implantació del 20% aproximadament i les hormones del creixement de l'ordre del 5%.
Els biosimilares s'accepten en el nostre entorn a través d'un procediment centralitzat a Europa. L'Agència Europea de Medicaments (EMA, per les seves sigles en anglès) és l'encarregada de definir els requisits que han de complir aquests productes per a la seva comercialització a la Unió Europea. Després de la publicació en 2004 del marc legal sobre biosimilares per part de la SEM, s'han editat una sèrie de guies i normes sobre requisits de qualitat, tant generals com específics per a cada producte, així com d'assajos preclínicos i clínics previs a l'aprovació dels productes. L'EMA ha estat pionera en el món a establir aquest tipus de normatives per a l'autorització de biosimilares. De fet, altres regions i països desenvolupats s'han basat en la normativa europea per a publicar els seus reglaments: Austràlia, el Japó, etc. El mateix ocorre amb les directrius marcades per l'Organització Mundial de la Salut (OMS) i l'Agència d'Aliments i Medicaments dels Estats Units (aquesta última organització està en fase d'aprovació de les primeres instruccions sobre biosimilares).
Finalment, l'aparició d'aquestes còpies de medicaments biològics, igual que l'aparició dels genèrics, ha generat un debat entorn de les possibilitats de garantir la mateixa qualitat, eficàcia i seguretat que els medicaments d'origen. Els metges encarregats de prescriure aquest tipus de fàrmacs han de saber que els biosimilares no aconsegueixen autorització si no es demostra que són comparables als productes originals. Per a això, la SEM estableix estrictes controls i requeriments. Per tant, és fonamental que el personal sanitari que prescriu i utilitza aquest tipus de fàrmacs disposi d'informació científica, precisa i sòlida sobre les peculiaritats d'aquests tractaments.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia




