Biocatalizadores per a una indústria més sostenible
2018/06/11 Lide Arana Urbieta - Biokimika eta Biologia Molekularra saileko irakasleaEHU Iturria: Elhuyar aldizkaria

De fet, necessitaríem anys per a aconseguir processos que es produeixen cada segon en les nostres cèl·lules. És meravellós com canvia la velocitat de qualsevol reacció quan ocorre en el nostre cos. Per exemple, una reacció contínua dels glòbuls vermells per a transportar CO? en la nostra sang, la deshidratació del bicarbonat (Figura 1), es produeix milions de vegades més lentament en el mitjà [1].
Quin és el nostre secret? Com aconseguim aquesta velocitat? Els éssers vius formem molècules encarregades d'accelerar o catalitzar les reaccions, anomenades biocatalizadores o enzims. Encara que no són sinònims, la majoria dels biocatalizadores són enzims, és a dir, proteïnes amb activitat catalítica.
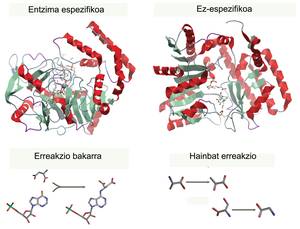
Per a cada procés hi ha un enzim específic que catalitza una i una sola reacció (per a utilitzar un únic tipus de reactiu i crear un únic producte), per la qual cosa un enzim no pot produir dos productes. Són els catalitzadors més eficients i poderosos coneguts (molt més potents que qualsevol catalitzador inorgànic) i, encara que els utilitzem des de temps remots, el desenvolupament experimentat en els últims anys ha fet que avui dia siguin molècules amb moltes aplicacions. Les utilitzem per a millorar la producció industrial de diferents productes de la vida diària.
Al nostre voltant es troben molts exemples d'ús industrial dels enzims, que han entrat gairebé inconscientment en el mercat. Alguns s'utilitzen per al tractament industrial del menjar, com la producció de llet sense lactosa. Un altre ús conegut són els mesuraments utilitzats en els controls de qualitat, la majoria de les quals es basen en l'activitat d'algun enzim. A més, en la indústria farmacèutica, els enzims poden utilitzar-se per a obtenir una producció més específica de fàrmacs. Els enzims utilitzen un únic substrat per a formar un únic producte, per la qual cosa s'eviten les mescles moleculars (estereoespecíficas) que es generen en una síntesi química, evitant en alguns casos productes secundaris perillosos. No obstant això, l'àmbit d'aplicació més ampli se centra en la millora de la sostenibilitat dels processos industrials per a la generació més ecològica de productes químics (mitjançant processos no contaminants en condicions biològiques). A més, es produeixen nombrosos enzims que poden ajudar a millorar els processos de rentada (detergents per a lleixiu en aigües fredes) o mitigar la contaminació ambiental.
No obstant això, en la naturalesa no sempre es troben enzims que catalitzen processos del nostre interès. Com s'ha dit, cada enzim coneix un únic tipus de substrat, proporcionant un producte únic i específic, i diverses reaccions d'interès industrial no es donen en els éssers vius. Per tant, hem començat a crear nous enzims o a millorar les que teníem, aprofitant el coneixement dels enzims i les tecnologies disponibles. Fins ara, la via més comuna ha estat la d'optimitzar els enzims que ja coneixíem. Igual que es fa per a la millora de fruiteres o plantes, es produeixen mutacions en les proteïnes i se seleccionen els enzims de característiques preferides. Aquesta metodologia es denomina evolució corregida. A vegades, les mutacions es realitzen específicament en determinats punts, i en aquest cas es diu que s'ha utilitzat un disseny racional. No obstant això, el disseny de nous enzims des del buit s'està convertint cada vegada més en una metodologia que teòricament estendria enormement les possibilitats d'obtenir nous biocatalizadores [2].
Tal com és imprescindible comprendre el procés de disseny d'una màquina, per a poder sintetitzar un biocatalizador adequat és necessari comprendre plenament el seu funcionament i estructura. I què és exactament el que sabem sobre aquestes molècules?
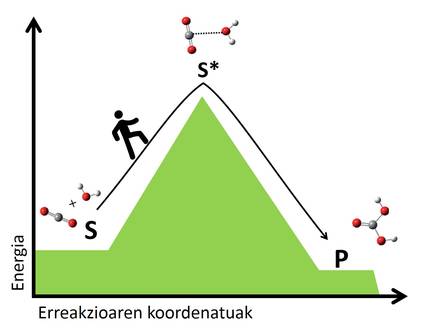
Segons la teoria de l'estat de transició, en totes les reaccions es reordenen els àtoms dels reactius, trencant els enllaços i formant noves molècules. En aquesta reorganització es creen estats de transició en els quals es formen les formacions atòmiques intermèdies de reactius i productes. Les molècules en transició són, en general, inestables i requereixen molta energia per a arribar a un estat de transició des dels reactius. Com més gran sigui el salt energètic per a arribar a l'estat de transició, més lent serà la reacció. És com passar d'una vall a un altre, com més alt sigui el pas, més llarg serà el viatge (figura 2).
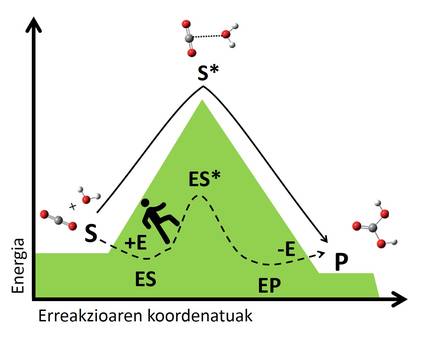
El mecanisme dels biocatalizadores es basa en l'estabilització d'aquestes situacions de transició mitjançant interaccions amb el substrat. L'enzim s'uneix al substrat formant un complex que crea una nova via de reacció inexistent (Figura 3). La complexitat és més estable que el sistema format per l'enzim i el substrat lliure, i aquesta estabilitat redueix el salt energètic necessari per a arribar a l'estat de transició, donant lloc a una via de reacció més ràpida. Seguint l'exemple anterior, podríem entendre com trobar una sendera que ens creua d'una vall a un altre, ja que és un camí que ens exigeix menys energia que pujar i baixar al cim, per la qual cosa arribarem més ràpid a l'altre costat.
Així, si volguéssim dissenyar un enzim per a catalitzar una reacció, necessitaríem una estructura compatible amb l'estat de transició de la reacció: una cosa capaç de completar interaccions estabilitzadores de la molècula, que servís per a estabilitzar el complex i accelerar la reacció. Perquè això ocorri correctament, a més de seleccionar els àtoms apropiats per a completar les interaccions amb el substrat (amb les seves característiques químiques específiques), els àtoms han d'estar situats en l'espai en una posició i angle determinats, formant una xarxa específica tridimensional [3].
En general, la zona de catàlisi (zona catalítica) és molt petita en comparació amb el volum total de la molècula. A tall d'exemple, podem analitzar l'enzim que catalitza la hidratació de CO?, l'anhidrasa carbònica (Figura 4). Com es pot observar, la zona d'interacció amb el substrat és molt petita si es té en compte el volum de tot l'enzim.
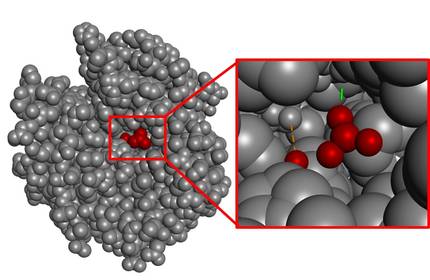
Se sap que la naturalesa mai malgasta energia. En conseqüència, la resta de l'estructura que no és l'espai catalític no hauria d'entendre's com un excedent, sinó com un indicador de la complexitat que suposa la consecució de l'espai català perfecte. De fet, els possibles canvis en l'àtom més allunyat d'aquesta estructura també podrien destruir la zona catalítica. Dit d'una altra manera, tota l'estructura és imprescindible perquè l'enzim tingui activitat i és un procés complex començar a dissenyar aquest tipus de molècules grans des de zero.
En aquest sentit, el desenvolupament de la bioinformática i la biologia estructural ha contribuït de manera important. En l'actualitat, la mecànica quàntica permet calcular l'estat de transició d'una reacció, simular la zona activa compatible i dissenyar l'estructura proteica que seria necessària per a completar l'estructura.
Aquesta metodologia ha permès catalitzar reaccions sense biocatalizador conegut i comprovar que és possible dur a terme aquest procés. A més, aquestes tècniques han contribuït a ampliar el nostre coneixement sobre l'estructura de les proteïnes. No obstant això, les característiques catalítiques d'aquests exemples obtinguts no aconsegueixen el nivell d'activitat dels enzims naturals, en general, tenen una capacitat de catàlisi més reduïda [4].
En conseqüència, encara que hi ha molt a millorar, el disseny de nous biocatalizadores ens permet controlar la velocitat de qualsevol procés del nostre interès. Aquestes tècniques permeten que els processos industrials es realitzin a temperatures inferiors, sense necessitat de dissolvents orgànics, amb millor eficiència, amb menys aigua i amb menys residus contaminants. Per tant, podem dissenyar els nanombres de la vida perquè els processos industrials siguin compatibles amb la vida.
Bibliografia
[1] Albert L. Lehninger, David L. Nelson i Michael M. Coix. Fonaments de Bioquímica (2008), Universitat del País Basc, 1a edició.
[2] Po-Ssu Huang, Scott E. Boyken i David Baker. - Nature (2016), 537 (7620):320-7.
[3] Karlheinz Drauz, Harald Gröger i Oliver May. Enzyme catalysis in organic synthesis (2012), Wiley-VCH.
[4] Kiss G, Çelebi-Ölçüm N, Moretti R, Baker D, Houk KN. Computational enzyme design. Angewandte Chemie International Edition in English (2013), 52(22):5700-25.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia