Bases génétiques d'adénocarcinome pulmonaire ovin
2014/04/01 Larruskain Mandiola, Amaia - Biologian doktoreaEuskal Herriko Unibertsitatea Iturria: Elhuyar aldizkaria

ABA est un cancer produit par un retrovirus
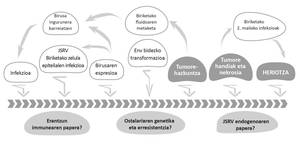
Les retrovirus constituent une famille nombreuse de virus ARN variés qui infectent de nombreuses espèces d'hôtes. Parmi eux se trouve le retrovirus des moutons Jaagsiekte du genre Betaretrovirus (Jaagsiekte Sheep Retrovirus; JSRV), agent de l'ABA. Les caprins et les espèces de moutons sauvages peuvent également souffrir de cette maladie. La transmission du JSRV est principalement produite par l'appareil respiratoire en contact direct avec les animaux contaminés (Figure 1).
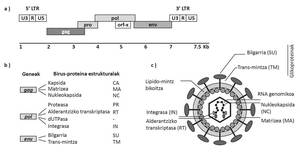
Le JSRV est spécial parmi les virus puisque ses cellules cibles (pneumocytes type II et cellules Klara) sont des cellules épithéliales pulmonaires. En outre, étant donné que le JSRV a un génome simple codant exclusivement des protéines essentielles, il est également spécial le mécanisme utilisé pour causer le cancer. Il convertit les cellules cibles en cellules cancéreuses de protéines Env d'emballage de virus (Figure 2). Le développement de l'ABAO est lent et seulement dans la phase finale de la maladie apparaissent des symptômes cliniques, parmi lesquels se trouvent les difficultés respiratoires des animaux à mesure que la taille des tumeurs pulmonaires augmente et le fluide propre de l'ABAO s'accumule.
Pourquoi savons-nous si peu au sujet d'ABA ?
En général, on a peu étudié la base génétique des maladies des vignes par rapport à d'autres espèces d'animaux domestiques d'intérêt économique majeur. Par conséquent, l'information et les ressources disponibles sont souvent rares.
En outre, les chercheurs qui ont commencé à étudier ABA ont rencontré un problème. Dans le génome du mouton il ya plus de 30 copies très similaires à JSRV, endogènes JSRV (enJSRV). Ces éléments, à la suite d'une ancienne colonisation du JSRV, sont devenus une partie du génome de l'hôte. Le JSRV et les enJSRV ont dû être caractérisés pour mener à bien les recherches. Bien qu'il y ait très peu de données sur la réponse immunitaire au JSRV, il y a une chose claire: Une des caractéristiques d'ABA est l'absence d'une réponse anticorps contre le JSRV. On croit que l'expression de certaines des enJSRV a rendu les moutons immunologiquement tolérés par le JSRV.
Contrôle et importance
Les infections des rétrovirus sont difficiles à contrôler. Dans le cas de l'ABA, la seule façon de contrôler est l'élimination des animaux infectés et malades, mais a une autre difficulté. En l'absence d'anticorps contre le JSRV, les tests sérologiques conventionnels ne peuvent pas être utilisés pour la détection. Seules des méthodes moléculaires sont disponibles via PCR (réaction enchaînée de la polymérase), mais comme le nombre de virus dans le sang est généralement faible, elles ne sont pas toujours fiables. Par conséquent, un animal avec un résultat négatif dans le test peut introduire un virus dans le troupeau.
ABA est très répandue aujourd'hui: L'Australie, la Nouvelle-Zélande et l'Islande sont les seuls pays apparemment indemnes de la maladie. ABA est le processus de cancer le plus fréquent chez les brebis et les pertes potentielles peuvent être significatives (Figure 3). Elle affecte surtout les jeunes brebis adultes, ce qui entraîne des pertes économiques par la diminution de la production et la mort prématurée des animaux. En outre, il est une préoccupation concernant le bien-être animal, car il ne peut pas éviter la mort des animaux.
Dans le cas du JSRV, aucun vaccin ou traitement efficace n'a pu être développé, car on ne sait pas quels gènes ou procédés immunologiques peuvent être liés à la résistance. Dans ces cas et dans les cas où les agents pathogènes développent leur résistance aux vaccins, bien qu'il existe une autre stratégie qui peut être utilisée, la sélection d'animaux à résistance propre, qui nécessite également l'identification de marqueurs génétiques nécessaires à la sélection d'individus résistants.
La recherche d'ABA peut non seulement être bénéfique pour les moutons, mais aussi pour les humains. En fait, les appareils respiratoires des deux espèces sont très similaires, de sorte que le mouton peut servir d'exemple pour la recherche de nombreuses maladies humaines. ABA ressemble clairement à un cancer humain concret, le carcinome broncho-alvéolaire. Comme l'incidence de ce dernier augmente, il faut la présence de marqueurs génétiques qui permettent d'identifier qui peut être à risque de développer un cancer. La recherche de l'ABA peut donc aider à mieux connaître la carcinogenèse pulmonaire humaine.
Recherche de gènes de résistance ou de sensibilité
L'interaction entre les hôteliers et les virus est complexe et, souvent, les détails de cette interaction ne sont pas entièrement connus. Les hôteliers ont développé des mécanismes pour se protéger des attaques de virus et d'autres pathogènes, tels que l'immunité intrinsèque et adaptative. Dans certaines populations humaines et animales, il a été démontré qu'il existe une variable génétique qui détermine la sensibilité/résistance à certaines maladies, souvent influencée par les polymorphismes des gènes de réponse immunitaire.
Malgré les rares recherches menées autour de l'ABAO, la variable génétique de l'hôte semble influencer le développement de l'infection et de la maladie. Dans certaines races ou familles d'ovins, on a observé la prévalence de JSRV et les différents niveaux de mortalité par ABA. Pour mieux comprendre la pathogenèse de l'ABAO, il est nécessaire de préciser quelle est la base génétique qui peut résister à l'infection et au développement du cancer.
Les analyses associatives sont un moyen d'identifier les gènes qui apportent résistance/sensibilité. Dans ce type d'analyse, on analyse les marqueurs polymorphes des gènes sélectionnés en fonction (gènes candidats) chez les animaux malades et de contrôle. La présence de différences dans les fréquences peut indiquer que ce sont des gènes qui peuvent donner la sensibilité/résistance à la maladie.
Prenant une population de moutons latxas, des données obtenues dans une étude réalisée par Génomique et Santé Animale du Département de Génétique de l'UPV/EHU, il ressort que la pathogenèse de l'ABAO peut être influencée par les gènes impliqués dans des fonctions comme l'immunité intrinsèque et l'immunité adaptative.
L'histocompatibilité principale complexe (DHC) a été étudiée en profondeur par sa grande variabilité et par sa fonction: l'encodage des récepteurs pour la présentation des antigènes aux cellules immunitaires. En outre, certains travaux suggéraient que les gènes de la DCA ont influencé le développement de l'ABAO. Notre travail a associé certaines variantes de gènes de brebis latxa au développement du cancer, y compris trois allèles qui codent le point de liaison de l'antigène du gène DRB1. Les polymorphismes de cet endroit peuvent affecter la liaison et la présentation des antigènes.

En outre, l'association pour les deux candidatures géniques a été décrite pour la première fois. D'une part, nous avons lié les variations du gène MX1 (Myxovirus Resistance-1) à la sensibilité. La fonction de ce gène est de limiter le cycle des virus, bien que dans le cas de la brebis et le JSRV nous ne savons pas exactement quelles étapes limitent. Comme on l'a vu chez d'autres espèces, les polymorphismes de ce gène peuvent affecter l'efficacité de la protéine MX, pouvant avoir un effet similaire sur les moutons. D'autre part, nous avons associé la résistance CCR5 (C-C chemokine récepteur type 5). Le CCR5 traite le quimiotaxi ou le mouvement des cellules de réponse immunitaire, il est donc important dans la lutte contre les maladies infectieuses. On sait que les polymorphismes affectent l'expression du gène. En outre, le CCR5 a été associé à d'autres maladies rétrovirales, y compris Visna/Maedi, une autre maladie pulmonaire contagieuse des moutons.
Ainsi, ces résultats obtenus dans l'analyse associative, bien qu'ils devront être répliqués dans d'autres échantillons ou races ovines, peuvent servir de base à de futures conceptions de vaccins ou thérapies ou à des programmes de sélection d'animaux résistants.
Bibliographie Bibliographie
Merci de votre remerciement. Merci
Je tiens à remercier les institutions qui ont financé ce travail, la directrice Begoña Jugo, les camarades du laboratoire (Koldo Garcia, Maialen Sistiaga et Aitor Esparza) et Imanol Salegi.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia