Fundamentos genéticos del adenocarcinoma pulmonar ovino
2014/04/01 Larruskain Mandiola, Amaia - Biologian doktoreaEuskal Herriko Unibertsitatea Iturria: Elhuyar aldizkaria

ABA es un cáncer producido por un retrovirus
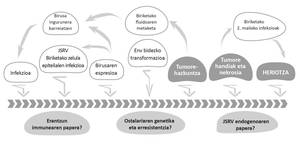
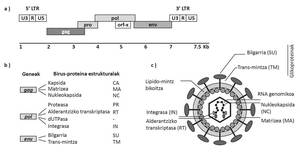
Los retrovirus constituyen una familia numerosa de virus RNA variados que infectan a numerosas especies de huéspedes. Entre ellos se encuentra el retrovirus de las ovejas Jaagsiekte del género Betaretrovirus (Jaagsiekte Sheep Retrovirus; JSRV), agente de la ABA. Aunque afecta especialmente a las ovejas, también pueden padecer esta enfermedad los caprinos y las especies de ovejas silvestres. La transmisión del JSRV se produce principalmente a través del aparato respiratorio en contacto directo con animales contaminados (Figura 1).
El JSRV es especial entre los virus ya que sus células diana (neumocitos tipo II y células Klara) son células epiteliales pulmonares. Además, teniendo en cuenta que el JSRV tiene un genoma simple que codifica exclusivamente proteínas esenciales, también es especial el mecanismo utilizado para causar cáncer. Convierte células diana en células cancerosas de proteínas Env del embalaje del virus (Figura 2). El desarrollo de la ABAO es lento y sólo en la fase final de la enfermedad aparecen síntomas clínicos, entre los que se encuentran las dificultades respiratorias de los animales a medida que aumenta el tamaño de los tumores pulmonares y se acumula el fluido propio de la ABAO.
¿Por qué sabemos tan poco sobre ABA?
En general, se ha investigado poco la base genética de las enfermedades ovinas en comparación con otras especies de animales domésticos de mayor interés económico. Por tanto, la información y los recursos disponibles a menudo son escasos.
Además, los investigadores que comenzaron a estudiar ABA se encontraron con un problema. En el genoma de la oveja hay más de 30 copias muy similares a JSRV, endógenos JSRV (enJSRV). Estos elementos, como consecuencia de una antigua colonización del JSRV, se convirtieron en parte del genoma del host. Tanto el JSRV como los enJSRV tuvieron que caracterizarse para poder llevar a cabo las investigaciones. Aunque hay muy pocos datos sobre la respuesta inmune al JSRV, hay una cosa clara: Una de las características de ABA es la ausencia de una respuesta anticuerpo contra el JSRV. Se cree que la expresión de algunas de las enJSRV ha hecho que las ovejas sean inmunológicamente toleradas con el JSRV.
Control e importancia
Las infecciones de los retrovirus son difíciles de controlar. En el caso de ABA, la única forma de controlar es la eliminación de animales infectados y enfermos, pero tiene otra dificultad. Y es que, al no generarse un anticuerpo contra el JSRV, no se pueden utilizar los tests serológicos convencionales para su detección. Sólo están disponibles métodos moleculares mediante PCR (reacción encadenada de la polimerasa), pero como el número de virus en la sangre suele ser bajo, no siempre son fiables. En consecuencia, un animal con resultado negativo en el test puede introducir un virus en el rebaño.
ABA está muy extendida en la actualidad: Australia, Nueva Zelanda e Islandia son los únicos países aparentemente libres de la enfermedad. ABA es el proceso de cáncer más frecuente en las ovejas y las posibles pérdidas pueden ser significativas (Figura 3). Afecta sobre todo a las ovejas adultas jóvenes, lo que ocasiona pérdidas económicas por la disminución de la producción y la muerte prematura de los animales. Además, es una preocupación en relación al bienestar animal, ya que no se puede evitar la muerte de los animales.
En el caso del JSRV no se ha podido desarrollar una vacuna o tratamiento eficaz, ya que no se conoce qué genes o procesos inmunológicos pueden estar relacionados con la resistencia. Tanto en estos casos como en los casos en los que los patógenos desarrollan su resistencia a las vacunas, aunque existe otra estrategia que puede ser utilizada, la selección de animales con resistencia propia, que también requiere la identificación de marcadores genéticos necesarios para la selección de individuos resistentes.
La investigación de ABA no sólo puede ser beneficiosa para las ovejas, sino también para los seres humanos. De hecho, los aparatos respiratorios de ambas especies son muy similares, por lo que la oveja puede servir de ejemplo para la investigación de muchas enfermedades humanas. ABA se parece claramente a un cáncer humano concreto, el carcinoma broncoalveolar. Como la incidencia de este último va en aumento, es necesaria la presencia de marcadores genéticos que permitan identificar quién puede estar en riesgo de desarrollar cáncer. Por tanto, la investigación del ABA puede ayudar también a conocer mejor la carcinogénesis pulmonar humana.
Búsqueda de genes de resistencia o sensibilidad
La interacción entre los hosteleros y los virus es compleja y, a menudo, no se conocen del todo los detalles de esa interacción. Los hosteleros han desarrollado mecanismos para protegerse de los ataques de virus y otros patógenos, como la inmunidad intrínseca y adaptativa. En algunas poblaciones humanas y animales se ha demostrado que existe una variable genética que determina la sensibilidad/resistencia a ciertas enfermedades, a menudo influenciada por los polimorfismos de los genes de respuesta inmune.
A pesar de las escasas investigaciones llevadas a cabo en torno a la ABAO, la variable genética del huésped parece influir en el desarrollo de la infección y la enfermedad. En algunas razas o familias de ovino se ha observado la prevalencia de JSRV y los diferentes niveles de mortalidad por ABA. Para comprender mejor la patogénesis de la ABAO es necesario aclarar cuál es la base genética que puede dar resistencia a la infección y al desarrollo del cáncer.
Los análisis asociativos son una forma de identificar los genes que aportan resistencia/sensibilidad. En este tipo de análisis se analizan los marcadores polimórficos de los genes seleccionados en función (genes candidatos) en animales enfermos y de control. La presencia de diferencias en las frecuencias puede indicar que son genes que pueden dar sensibilidad/resistencia a la enfermedad.
Tomando una población de ovejas latxas, de los datos obtenidos en un estudio realizado por Genómica y Sanidad Animal del Departamento de Genética de la UPV/EHU, se desprende que la patogénesis de la ABAO puede estar influenciada por los genes implicados en funciones como la inmunidad intrínseca y la inmunidad adaptativa.
La Histocompatibilidad Compleja Principal (DHC) ha sido estudiada en profundidad por su gran variabilidad y por su función: la codificación de receptores para la presentación de antígenos a células inmunitarias. Además, algunos trabajos sugerían que los genes de la DCA influyeron en el desarrollo de la ABAO. Nuestro trabajo ha asociado determinadas variantes de genes de oveja latxa con el desarrollo del cáncer, incluyendo tres alelos que codifican el punto de unión del antígeno del gen DRB1. Los polimorfismos de este lugar pueden afectar a la unión y presentación de antígenos.

Además, se ha descrito por primera vez la asociación para ambas candidaturas génicas. Por un lado, hemos relacionado las variaciones del gen MX1 (Myxovirus Resistance-1) con la sensibilidad. La función de este gen es limitar el ciclo de los virus, aunque en el caso de la oveja y el JSRV no sabemos exactamente qué pasos limita. Como se ha visto en otras especies, los polimorfismos de este gen pueden afectar a la eficacia de la proteína MX, pudiendo tener un efecto similar en las ovejas. Por otro lado, hemos asociado la resistencia CCR5 (C-C chemokine receptor type 5). El CCR5 se ocupa del quimiotaxi o movimiento de las células de respuesta inmune, por lo que es importante en la lucha contra las enfermedades infecciosas. Se sabe que los polimorfismos afectan a la expresión del gen. Además, el CCR5 se ha asociado a otras enfermedades retrovirales, incluida Visna/Maedi, otra enfermedad pulmonar contagiosa de las ovejas.
Así, estos resultados obtenidos en el análisis asociativo, aunque deberán ser replicados en otras muestras o razas ovinas, pueden servir de base en futuros diseños de vacunas o terapias o en programas de selección de animales resistentes.
Bibliografía
Agradecimiento
Quiero agradecer a las instituciones que han financiado este trabajo, a la directora Begoña Jugo, a los compañeros del laboratorio (Koldo Garcia, Maialen Sistiaga y Aitor Esparza) e Imanol Salegi.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia