El CIC nanoGUNE desarrolla una técnica para diferenciar más detalladamente la estructura de proteínas que nunca
2013/12/18 Carton Virto, Eider - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
La estructura de la proteína es fundamental para que la proteína cumpla su función. Asimismo, la estructura espacial secundaria que adopta la proteína (hélice alfa o página beta) juega un papel importante en algunas enfermedades neurodegenerativas. En consecuencia, el desarrollo de técnicas de detección a escala tan detallada de estas estructuras secundarias puede ser de gran ayuda en la investigación.
El método, desarrollado por un equipo de investigadores de CIC nanoGUNE, la Universidad Libre de Berlín y el Instituto Neaspec, ha publicado sus resultados en la revista Nature Communications.
Mapas a escala nanométrica
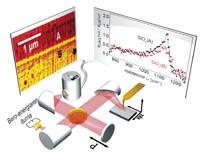
La técnica desarrollada se basa en la nanoespectroscopia infrarroja (nano-FTIR). Se trata de una técnica óptica que combina el microscopio óptico de barrido de campo cercano (s-SNOM) con la espectroscopia infrarroja (FTIR) por transformación de Fourier. En la espectroscopía nano-FTIR se ilumina una punta metálica apuntada con un láser infrarrojo de banda ancha y se analiza la luz retrospectiva con un espectroscopio de Fourier transformado especialmente diseñado.
_galeria.jpg)
Al ser una herramienta habitual para estudiar la estructura secundaria de las proteínas, no permite realizar un mapa a escala nanométrica de proteínas. Los investigadores de CIC nanoGUNE han afinado esta técnica obteniendo una resolución inferior a los 30 nm. “La punta es una especie de antena para la luz infrarroja que envuelve la luz en la punta. El nanofoco de este pico superior puede considerarse como una fuente ultratxiki de luz infrarroja. Es tan pequeño que sólo ilumina una superficie de 30x30 nm, que es la escala de grandes complejos proteicos”, explica Rainer Hillenbrand.
Los investigadores han estudiado con la nueva técnica los virus individuales, los complejos de ferritina y los espectros infrarrojos de las pequeñas fibras de insulina, distinguiendo estructuras que no alcanzarían la espectroscopia estándar. “En una mezcla de fibras de insulina y virus, la espectroscopia estándar FTIR no detectó la presencia de virus alfa-heliz, ha subrayado el biólogo del grupo, Simon Poly. También han sido capaces de medir el espectro infrarrojo de una sola partícula de ferritina: Son complejos de 24 proteínas de muy baja masa, tan sólo 1 attogramos (10-18 g); los investigadores han podido diferenciar claramente las estructuras alfa hélice.
Según los investigadores, un aspecto de gran importancia práctica es que el espectro nano-FTIR se combina muy bien con el tradicional espectro FTIR y que la resolución espacial aumenta más de 100 veces la espectroscopia infrarroja convencional. Hillenbrand ha calificado de "emocionante" las nuevas posibilidades que ofrece la técnica nano-FTIR. “Con las puntas más afiladas y la mejora de la función de las antenas esperamos que en el futuro se obtenga el espectro infrarrojo de proteínas únicas”, ha afirmado.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia