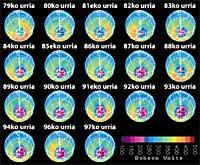
Agujero de la capa de ozono
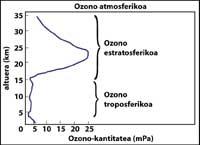
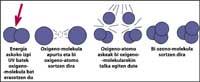
La capa de ozono se encuentra en la estratosfera, entre 15 y 35 km, rodeando todo el planeta. La capa de ozono está formada por moléculas de gas de ozono. Cada molécula de ozono está formada por tres átomos de oxígeno de carácter inestable. Hay que recordar que las moléculas de oxígeno están formadas por dos átomos de oxígeno. La molécula de ozono actúa como filtro para la radiación ultravioleta denominada B, es decir, entre 280 y 320 nanómetros (denominada en inglés UV-B). Las radiaciones UV-B son nocivas para los animales y las plantas del planeta y, por supuesto, también para el ser humano.
Sin embargo, la radiación ultravioleta es imprescindible para la formación de ozono, ya que la radiación ultravioleta libera moléculas de oxígeno. Estos reaccionan con otras moléculas de oxígeno para formar ozono.
Efectos de la radiación UV-B y ozono en el ser humano
La falta de ozono estratosférico es perjudicial para los animales y plantas del planeta. Pero la presencia de ozono a nivel de la superficie terrestre también es perjudicial. Esto se debe a que el ozono es inestable, por lo que reacciona fácilmente con otros elementos químicos. El ozono dificulta la respiración, especialmente a los seres humanos con asma, y causa daños en árboles y cosechas. Los científicos aún no han aclarado cómo se puede producir un gas inestable como el ozono a nivel de la superficie terrestre, ni por qué ocurre sobre todo en el entorno de las grandes ciudades. Sus habitantes ya están acostumbrados a las ‘alarmas de ozono’ como la capital chilena, Santiago de Compostela.
¿Contaminación humana o contaminación natural?
Está
claro que el cloro (Cl) ha llegado a la estratosfera, pero ¿se debe a la contaminación humana o ha llegado a la estratosfera espontáneamente? De hecho, en la superficie terrestre se pueden encontrar grandes cantidades de cloro, como en forma de sal marina (NaCl).
Cuando el agua del mar se evapora también se evapora una cantidad de sal, pero vuelve al suelo con lluvia, hielo o nieve, porque es soluble en agua. Otro lugar donde se puede encontrar cloro en grandes cantidades son las piscinas, pero este cloro también es soluble en agua, por lo que no presenta problemas.
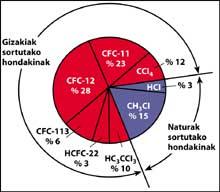
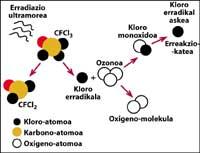
Una de las fuentes de contaminación natural son los volcanes, que arrojan cloruro de hidrógeno a la atmósfera, pero el cloro se convierte en ácido clorhídico, soluble en agua. Sin embargo, los halocarbonos utilizados por el ser humano, los CFCs, el tetracloruro de carbono (CCI4) y el cloroformo de metilo (CH-CCI3) no son solubles en agua por lo que no caen en la Tierra con lluvia, hielo o nieve. Por ello, llegan a la estratosfera acompañados de viento. Teniendo en cuenta esto, es evidente que el cloro estratosférico que destruye el ozono es producido por el ser humano.
¿Cómo se destruye la capa de ozono?
Está
totalmente demostrado que el cloro destruye el ozono. Este proceso se produce cuando la radiación UV libera el átomo de cloro de CFC. El átomo de cloro reacciona y destruye con una molécula de ozono, pero tras la reacción el átomo de cloro permanece libre. Sigue reaccionando y destruyendo otras moléculas de ozono. Este proceso es totalmente nocivo ya que una molécula de cloro puede destruir cerca de 100.000 moléculas de ozono. Este proceso queda cuando el cloro se combina con otro elemento. La vida media de un átomo de cloro en la estratosfera es de unos dos años.
Pero es sabido que esta reacción se produce en la estratosfera y que una molécula de CFC tiene más peso que el aire, entonces ¿cómo es posible que una molécula de CFC llegue a la estratosfera? Esto se debe a que el viento siempre está en movimiento y mezcla las sustancias químicas presentes en el viento. Esta mezcla y movimiento sube la molécula de CFC con una fuerza mayor de la que caería con su peso. Además, la molécula CFC no reacciona a nivel de la Tierra ni se disuelve en el agua, por lo que la molécula CFC es fácilmente alcanzable con su peso en la estratosfera.
¿Por qué se utilizaron los CFCs?
Una vez leída la pregunta anterior, a cualquiera se le ocurre la otra. Los CFCs fueron creados por los químicos de General Motors en la década de 1920. El uso de CFCs fue muy amplio y se emplearon en muchas industrias. La razón es que conseguir CFC era bastante barato. Además, cabe destacar su estabilidad, ya que las pruebas realizadas demostraron que no reaccionaba con otras moléculas. A esto hay que añadir que no era nocivo como ser. Además, no se disuelve en el agua. Sin embargo, nadie pensó lo que iba a pasar cuando esta molécula llegó a la estratosfera.
¿Por qué en los polos?
Está claro que la contaminación no se produce en los polos, sino a miles de kilómetros de allí. Por ello, parece muy raro que los efectos de la contaminación se produzcan en los polos. Pero este hecho tiene razón.
Los CFCs se producen y liberan principalmente en el hemisferio norte. En concreto, el 90% de los CFCs del mundo se producen en la antigua Unión Soviética, Japón, Europa y EEUU.
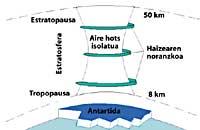
A continuación, los CFCs suben a la estratosfera utilizando corrientes de aire en los trópicos. Una vez en la estratosfera, llegan a ambos polos aprovechando los vientos. Por ello, los CFCs se extienden por toda la atmósfera. Pero hay una diferencia entre ambos polos: la meteorología. La diferencia meteorológica se basa en la superficie terrestre polar, ya que el Polo Sur es una gran superficie de terreno rodeado de mar, mientras que el Polo Norte tiene una menor superficie terrestre y el mar que lo rodea tiene grandes extensiones de tierra, como las islas del norte de Canadá, Groenlandia, Escandinavia...
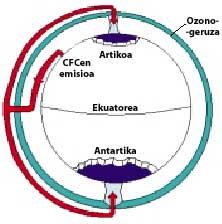
La meteorología del polo sur produce temperaturas frescas. En los seis meses de verano hay luz 24 horas al día y el ozono absorbe los rayos UV. Esto provoca un ligero aumento de la temperatura. Sin embargo, durante los seis meses de invierno el aire se enfría ligeramente, por lo que baja el aire y comienza a girar sobre la Antártida. La velocidad del aire asciende hasta los 400 km/h para la primavera. Este remolino giratorio mantiene el aire interior, por lo que no hay confusión con el aire exterior. Hasta aquí no hay diferencias entre la Antártida y el Ártico. Pero en el Ártico este remolino de aire se rompe varias veces debido a las tierras mencionadas. En consecuencia, el aire interior del remolino se mezcla con el exterior.
En la Antártida, por el contrario, este remolino no tiene obstáculos y la temperatura Ártica es 10 o 15 veces menor que en invierno, es decir, alrededor de 80 C bajo cero. En la primavera antártica, con los primeros rayos solares, la estratosfera comienza a calentarse y a disminuir la fuerza del remolino de aire. Para mediados de noviembre este remolino desaparece completamente. Sin embargo, a temperaturas frías anteriores, el ácido nítrico produce nieblas estratosféricas de hielo, lo que provoca un ambiente químico favorable para la destrucción del ozono.
En estas nieblas, HCl y ClONO 2 reaccionan entre sí formando ácido nítrico y cloro (Cl 2). Esta molécula, en principio, es estable y no reacciona con el ozono, pero los rayos solares lo fotolizan y se descompone en dos cloro radicales libres que reaccionan con el ozono. En el Polo Norte las temperaturas más altas reducen la generación de nieblas y por tanto la destrucción de ozono.
¿Aumentará el agujero de la capa de ozono?
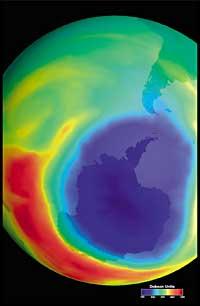
Últimamente ha habido un temor: si el agujero de la capa de ozono llegará a Sudamérica, la tierra más cercana a la Antártida. Pero antes de responder hay que saber qué se considera un agujero para Sudamérica. Los expertos le llaman agujero cuando en Sudamérica la columna de ozono es menor de 220 DU (Dobson unit). Teniendo en cuenta esto, se puede afirmar que el agujero de ozono ha llegado a Sudamérica. De hecho, en el sur de Chile se han tenido medidas inferiores a 220 UD. Pero esto sólo ha ocurrido entre septiembre y octubre, y sólo durante unos pocos días. Por tanto, la arista sudamericana puede considerarse como el límite del agujero de la capa de ozono.
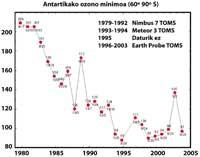
Los científicos están esperanzados de cara al futuro. De hecho, los CFCs están prohibidos desde la firma del protocolo de Montreal (1987). Teniendo en cuenta los estudios realizados, se espera que dentro de 50 años desaparezcan los CFCs, recuperando así el equilibrio natural del ozono.
Pero todos estos datos deben tomarse con mucha cautela, ya que se pensaba que en el año 2000 el agujero de la capa de ozono alcanzó la mayor extensión de la historia y que en los años siguientes no se habría incrementado. En la naturaleza, sin embargo, hay muchos elementos a tener en cuenta, como es el caso de que en 2002 no se apreciara ningún agujero aparente debido al calor del año, pero en 2003 apareció con su extensión habitual, siendo el segundo más grande conocido.
Sin embargo, es cierto que la concentración troposférica de sustancias nocivas para el ozono está disminuyendo desde 1995. Pero las sustancias nocivas necesitan entre tres y seis años para pasar de la troposfera a la estratosfera. En los últimos años la concentración de cloro en la estratosfera ha permanecido constante y ha comenzado a descender ligeramente. El futuro del ozono, sin embargo, no sólo depende del cloro, sino también de otras sustancias utilizadas por el hombre (metano, óxido nitroso, partículas de sulfato). Y el cambio climático.

En resumen, puede decirse que entre las sustancias presentes en la atmósfera se dan procesos muy complejos y que es difícil tener en cuenta todas las variables que intervienen para detectar qué ocurrirá en el futuro. Pero los datos que tenemos son esperanzadores, parece que la destrucción de ozono se ha estancado y va a mejorar poco a poco. Sin embargo, está claro que la atmósfera futura no será la misma que la que existía antes de la década de 1970, y las sustancias atmosféricas deberán ser analizadas con cautela.
Daños a la radiación ultravioleta En la actualidad está demostrado que, además de pruebas claras y precisas, el aumento de la radiación UV-B tiene efectos perjudiciales para el ser humano:
Afecta al sistema inmunológico. Hace daño a los ojos, por ejemplo, produce cataratas. Profundiza en las quemaduras solares y envejece la piel. Aumenta el riesgo de dermatitis alérgica y tóxica. Fortalece algunas enfermedades de bacterias y virus. Reduce el rendimiento de la pesca y las cosechas. |
¿Cómo se mide el ozono?
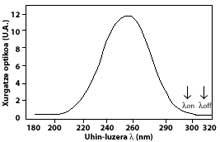
La técnica más utilizada es la de absorción diferencial. La técnica consiste en medir la radiación de dos ondas que llegan del sol a la superficie terrestre. La longitud de onda de estas dos ondas es muy similar, pero en esas longitudes de onda la atenuación del ozono es muy diferente.
En concreto, la lambda on SUB off es de 315 nanómetros, donde la absorción de la sección efectiva de ozono es varias veces mayor que la de lambda on en lambda off. Además, la atenuación de las radiaciones solares de otros componentes presentes en la atmósfera en esta parte del espectro es muy similar, por lo que la división entre la irradiación de dos longitudes de onda da cuenta de la cantidad de ozono.
En concreto, se puede decir que si llamamos I lambda a la radiación solar de una determinada longitud de onda que llega a la Tierra, su valor es:

donde,
- L la longitud de la atmósfera atravesada.
- Coeficiente de atenuación debido a la dispersión k M lambda Mie.
Irradiación solar I o lambda fuera de la atmósfera. Coeficiente de atenuación debido a los componentes atmosféricos
K ab lambda (vapor de agua, ozono, N 2 , 0 2 , CO 2 ...).
k Coeficiente de atenuación debido a la dispersión A lambda Rayleigh.
Para longitudes de onda alrededor de lambda on y lambda off, el valor de los coeficientes Rayleigh y Mie puede considerarse igual, es decir, k A lambda on = k A lambda off y k M lambda on = k M lambda off. Asimismo, en esta zona del espectro, la absorción de los componentes atmosféricos es despreciable, a excepción del ozono. Por tanto, la atenuación que sufre la luz solar en esta zona del espectro se debe únicamente al ozono estratosférico. Es habitual que lambda on = 300 nm y lambda off = 315 nm y k o lambda on = 7 ko lambda off, es decir, la absorción de lambda on es siete veces mayor que la de lambda off. En consecuencia, el coeficiente de intensidad de lambda on y lambda off se obtiene como:
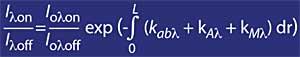
Si el coeficiente de absorción de ozono se define mediante k o lambda , la concentración de ozono (N) y su sección de absorción eficaz (T), la expresión anterior queda como sigue:
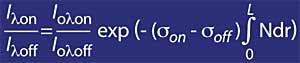
Pero hay que tener en cuenta el aire, para ello se utilizará mr, donde mr es la masa relativa del aire. Cabe destacar que el factor mr se corrige en función de la hora solar, el día del año y la latitud para que sea fiable.

donde,
- si D es la anchura media de la capa de ozono.
- N es la concentración media de la capa de ozono.
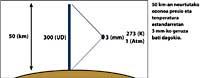
En consecuencia, se ha explicado cómo conociendo las medidas I lambda on e I lambda off se puede conocer la cantidad de ozono.
Las flechas de la imagen de la izquierda indican dónde se realiza la absorción diferencial. Lambda on = 300 nm y lambda off = 315 nm, donde la eficacia de absorción del ozono es varias veces mayor que la lambda on en lambda off.
Además, hay que tener en cuenta dónde estamos y qué día del año es para saber si el resultado de la medida de ozono es alto o bajo.
Historia del agujero de la capa de ozono
Se descubrió por primera vez en 1982 cuando se estaba eliminando la capa de ozono, cuando se dieron a conocer los datos de la columna de ozono medida por la estación japonesa Syowa (69H, 39E), situada en la Antártida. Las mediciones comenzaron en 1964 y demostraban que a partir de 1975 el ozono tenía una clara tendencia a la baja.
En el resto de estaciones dispersas por la Antártida se observó un comportamiento similar al ozono, y en todas ellas la disminución del ozono comenzó en los años 70. Además, los científicos descubrieron que la disminución del ozono comenzaba en la primavera austral y desaparecía a toda velocidad. Los científicos del mundo se agobiaron porque si el proceso siguiera adelante podrían tener consecuencias graves para el hombre y el planeta.
Años después, J dio un paso importante para entender lo que se conocía como el agujero de la capa de ozono. Lovelock. De hecho, el científico inglés se embarcó en un proyecto que tenía como objetivo estudiar la dinámica que se producía en la alta atmósfera. Para ello, se centró en aquellas sustancias emitidas a la atmósfera con gran frecuencia que tenían una larga vida antes de su destrucción. Así, siguiendo las huellas de estas sustancias, descubrió cómo llegaron a la Antártida desde los lugares donde se formaban.
Llamó marcadores a aquellas sustancias que iba a utilizar para conocer el comportamiento de la atmósfera. Tras analizar diversas sustancias, seleccionó los CFCs para este trabajo, debido a su uso y estabilidad. Mientras seguía la huella de los CFC, se dio cuenta de que estaban en alta concentración en la Antártida.
Se consideraba que los CFCs eran muy estables y que no afectaban a nada, por eso se utilizaban tantas industrias totalmente diferentes y para muchos propósitos. Pero Molina y Rowland demostraron en 1972 que en los CFCs la irradiación ultravioleta liberaba cloro que destruía ozono.
Cuando se conoció todo ello, los grupos ecologistas iniciaron campañas contra los CFCs para concienciar a la gente. De esta forma, se amplió la postura contra los CFCs. Los políticos, ante la gravedad de la situación, apoyaron la prohibición de los CFCs en varias conferencias, siempre con más lentitud de lo deseado por los ecologistas y más rápido de lo deseado por la industria química.
Se habló por primera vez en la Conferencia sobre el Medio Humano sobre la capa de ozono celebrada en Estocolmo (1972). En 1977 los expertos se reunieron en Washington para llevar a cabo el Plan Mundial de la Capa de Ozono. Cuatro años después, las Naciones Unidas propusieron un tratado sobre el problema de la capa de ozono. El primer acuerdo internacional se firmó en Viena en 1985, donde se expuso la intención de investigar las consecuencias de la falta de capa de ozono.
Pero el convenio más conocido es el firmado en 1987 en Montreal. Fue firmado por 165 países, que aglutinaron el 90% de la producción mundial, y su objetivo era acabar con las sustancias destructoras del ozono. Para ello establecieron dos fechas: 1996 para los pueblos desarrollados y 2010 para otros pueblos. Con el objetivo de reforzar este acuerdo se alcanzó un acuerdo de reunirse al menos cada cuatro años. Las más importantes han sido Viena (1995) y Montreal (1997). En la actualidad 180 países han firmado el convenio de Montreal.
Bibliografía
- Ciencias de la naturaleza
Vol. 12, Planeta (1997).
Cómo funciona la naturaleza
Debate (1992).
Uriarte, A.
Ozono: la catástrofe que no llega
Tercera Prensa (1995).
Cacho, J. y Sainz de Aja, J.
Antártida: el agujero de ozono.
Tabapress (1989).
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian