Nanomedicina como tratamiento del cáncer de mama
El cáncer de mama es la enfermedad que más muerte provoca en las mujeres. Las terapias que se utilizan actualmente para combatir el cáncer son principalmente la quimioterapia y la radioterapia [1, 2], y son técnicas altamente invasoras que provocan numerosos efectos indeseables [3]. La quimioterapia convencional afecta a todo el organismo, dañando tanto las células cancerosas como las sanas. Por ello, se limita la dosis de quimioterapia al tratarse de un tratamiento muy tóxico. Las nanopartículas pueden ser recursos terapéuticos adecuados para superar esta falta de especificidad de la quimioterapia convencional [4].
Así, mediante nanopartículas, es posible liberar el fármaco contra el cáncer en el lugar de aplicación o concentrarlo en el tejido diana reduciendo la toxicidad sistémica. Además, solucionan los problemas de algunos fármacos como la baja solubilidad o la inestabilidad química. Además, se mejora la farmacocinética de los fármacos y se reducen las resistencias de los fármacos utilizados en la quimioterapia [5]. Como consecuencia de todo ello, las nanotecnologías desarrolladas para el tratamiento del cáncer de mama han conseguido una mayor eficacia y supervivencia en pacientes con cáncer de mama y una reducción de los efectos no deseados de la quimioterapia.
Características y mecanismos de accionamiento de las nanopartículas
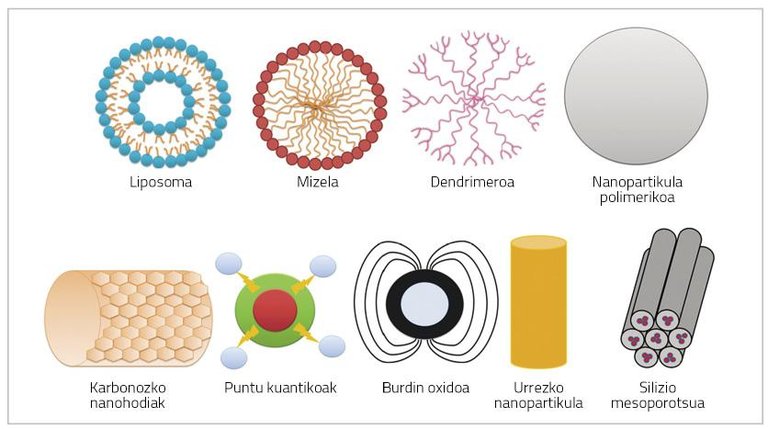
Las nanopartículas son partículas de muy pequeño tamaño (< 100 nm) que pueden estar formadas por polímeros, lípidos, virus o compuestos organometálicos (Figura 1) [6].
Para que los medicamentos utilizados en el tratamiento del cáncer de mama sean plenamente efectivos es necesario tener en cuenta dos factores. Por un lado, llegar al tejido en el que se encuentra el tumor la mayor dosis posible de medicamentos, y por otro, que el medicamento que llega al tejido afecte directamente a las células cancerosas. Ambas acciones pueden producirse mediante enrutamientos pasivos o activos por nanopartículas (Figura 2) [4].
Encaminamiento pasivo
El fármaco se administra de forma inactiva y al llegar al tejido tumoral se metaboliza, se activa y se convierte en un fármaco muy tóxico [7, 8, 9]. El encaminamiento pasivo se puede realizar de tres formas:
a) Aumento de la permeabilidad de los vasos sanguíneos y efecto de retención (EPR)
A medida que aumentan las células tumorales y los tejidos tumorales, aumenta su necesidad de oxígeno y nutrientes. Para satisfacer estas necesidades de oxígeno y nutrientes se crea un nuevo sistema de capilares sanguíneos que no se desarrolla completamente y que, por tanto, es más permeable para ciertas partículas de cierto tamaño. Es por ello que las nanopartículas suelen acumularse en células tumorales, lo que permite aumentar la dosis de medicamento que influirá en el interior de las células cancerosas sin causar toxicidad en células sanas [4, 8].
b) Microambiente tumoral
Esta estrategia considera el entorno del tumor. El fármaco se administra al paciente conjugado (de forma inactiva) con una molécula específica del tumor y, al llegar al mismo, el contorno del tumor lo convierte en una sustancia activa [10].
c) Administración in situ
La aplicación directa del fármaco quimioterapéutico en el tumor evita la toxicidad sistémica y permite reducir la dosis del fármaco. Por ejemplo, la administración de C mitomicina - dextrano conjugado en el interior del tumor permitió detectar una mayor concentración del fármaco anticanal en la zona del tumor y una disminución de la toxicidad sistémica [8].
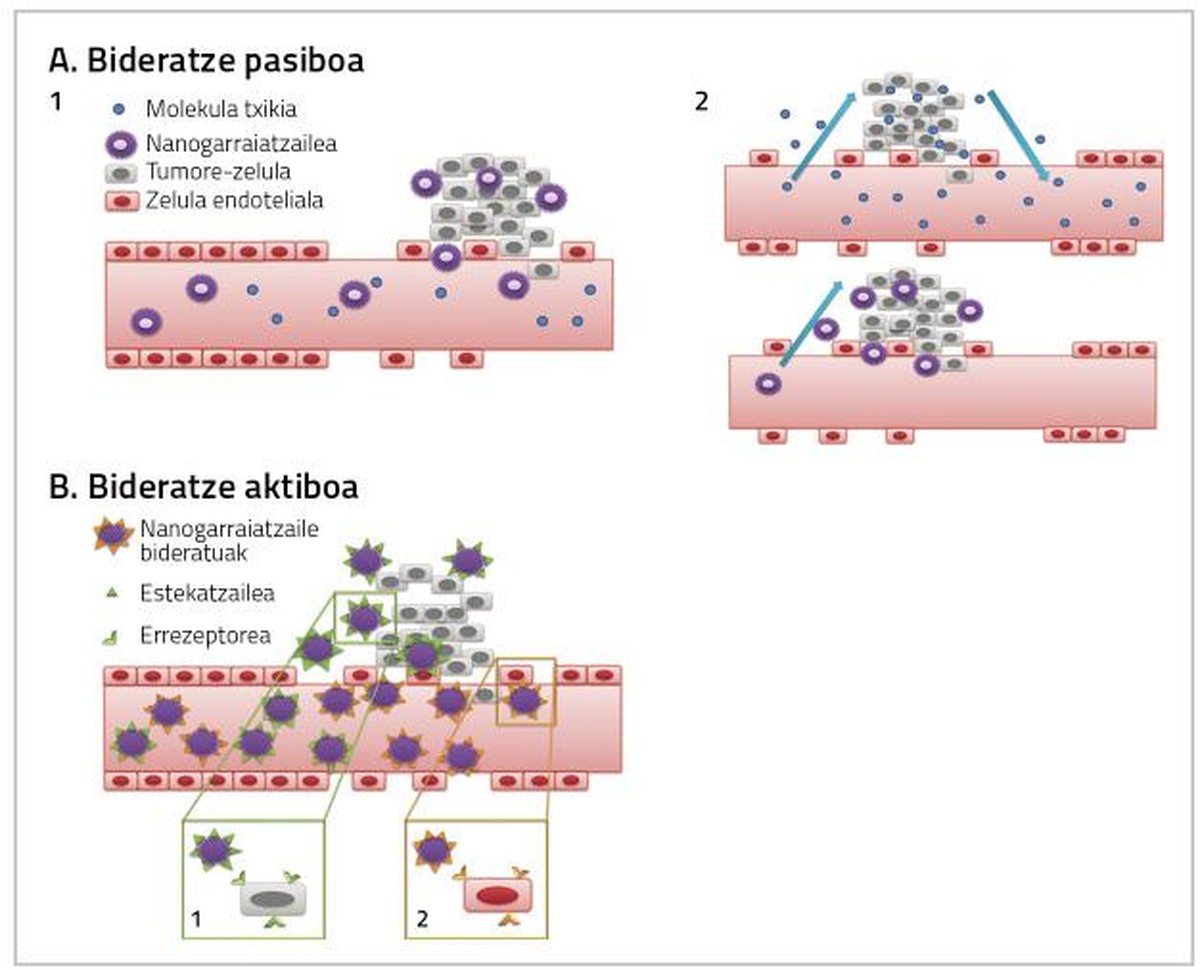
Enrutamiento activo
El propósito del enrutamiento activo consiste en interaccionar las nanopartículas conjugadas con las diana del área objeto del tratamiento, de forma que el tejido cancerígeno alcance una mayor dosis de fármaco (Figura 2).
Las células cancerosas presentan características similares a los tejidos sanos. Por ello, para la separación de estas células se utilizan ligantes específicos a los receptores que se sobreexpresan en las células cancerosas, generando interacciones específicas. Algunos ejemplos son la asociación de carbohidratos de lectina, receptores de ligantes y anticuerpos de antígenos [8, 9, 11].
a) Orientación a carbohidratos
Uno de los ejemplos más importantes es el del carbohidrato de lectina. Los carbohidratos que se encuentran en la superficie de las células tumorales no son como los de las células normales. La lectina es capaz de reconocer las glicoproteínas presentes en la superficie celular y asociarlas a ellas. En consecuencia, algunos hidratos de carbono interactúan con lectinas, creando enlaces celulares específicos. Las lectinas, por tanto, pueden ser moléculas para transferir el fármaco a las células o tejidos a los que se dirige. A través de esta asociación de carbohidratos de lectina se pueden desarrollar dos nanopartículas diferentes. Por un lado, las lectinas pueden ir integradas en nanopartículas e interaccionan con los carbohidratos presentes en la superficie de las células objetivo. Es lo que se conoce como conducción directa de lectinas. Por otro lado, los hidratos de carbono están integrados en nanopartículas para interactuar con las lectinas presentes en las células objetivo. Esto es lo que se denomina escalado inverso de lectinas [4].
b) Conducción de receptores
El fármaco se conjuga con un transportador polimérico que se une a las células gracias a un ligante que lleva en la estructura [12]. Un ejemplo es el receptor de folatos. Cuando un conjugado destinado a los folatos en la superficie celular se une a los receptores de folatos, la membrana plasmática recoge este conjugado del receptor y el ligante formando un endosoma. El pH endosómico se acidifica y a medida que las lisozimas se activan, el fármaco se va liberando del conjugado y se introduce en el citoplasma. Mientras tanto, el receptor de folato liberado vuelve a la membrana plasmática para reiniciar el proceso [4].
d) Tramitación de anticuerpos
Esta estrategia se basa en la acción de anticuerpos monoclonales para orientar las nanopartículas hacia el tejido tumoral [12]. Ejemplo de ello son los inmunoliposomas. Los liposomas conjugados con anticuerpos forman un enlace específico con el antígeno superficial de las células diana, mediante el cual el fármaco anticancerígeno llega al tejido tumoral (Figura 2) [13].
Reflexiones finales
A la vista de estas posibilidades, se puede prever la eficacia de estos nanomedicina. Sin embargo, son pocos los nanomedicina puestos en el mercado y todavía muchos de los existentes para su comercialización se encuentran en ensayos clínicos o en fases preclínicas. A pesar de que esto supone mucho tiempo y mucha financiación, los beneficios que pueden reportar las nanopartículas hacen necesario tener en cuenta su importancia. Por ello, será necesario realizar más investigaciones y desarrollar nuevas nanopartículas, ya que además de dar grandes avances en la tecnología farmacéutica y en la salud, pueden reportar un enorme beneficio a la sociedad.
Bibliografía
Buletina
Bidali zure helbide elektronikoa eta jaso asteroko buletina zure sarrera-ontzian