Gure gorputza, minbiziaren kontrako arma boteretsua
2015/12/01 Omaetxebarria Ibarra, Miren Josu - EHUko Biokimika eta Biologia Molekularra Saileko irakaslea eta ikertzailea | Osinalde Moraleja, Nerea - EHUko Biokimika eta Biologia Molekularra Saileko irakaslea Iturria: Elhuyar aldizkaria
Biziaren oinarrizko piezak dira zelulak; zenbat eta hobeto ezagutu zelulen egitura, funtzionamendua eta elkarrekin edota euren ingurunearekin dituzten elkarrekintzak, orduan eta gehiago ikusten ditugu perfekziotik hurbil dauden makinerien gisara. Zelulok gai dira milaka aldiz zatitzeko, eta oso konplexua den zatiketa-prozesua izugarri zehatza den arren, noizbehinka akatsak suerta daitezke. Akats horiek konpontzeko mekanismo ugari dituzte zelulek, baina, maiztasun txikiarekin bada ere, zenbait kasutan akatsok konponezinak dira. Halakoetan, zelulak kontrolik gabe zatitu daitezke, eta, hilezkor bihurtu; alegia, minbizia gara daiteke.
Tradizionalki, minbiziari agente kimiko edota erradioaktiboen bidez egin zaio eraso. Terapia horiek, hazkuntza azkarreko minbizi-zelulen DNA kaltetzeaz gain, zelula osasuntsuen DNAn ere badute eragina, eta, ondorioz, terapiak iraun bitartean kudeatu behar izaten dira terapia horien toxikotasuna eta albo-ondorio desatseginak. Hori horrela izanik, azken urteetan, aurrerapauso garrantzitsuak ematen ari da komunitate zientifikoa eta komunitate medikoa hain oldarkorrak ez diren terapia eraginkorragoak eta espezifikoagoak garatzen. Bide horretan, immunoterapia da nabarmen gailendu dena. Hain da itxaropentsua immunoterapiak urratu duen bidea, ezen Science aldizkariak 2013an urteko aurrerapen izendatu baitzuen. Minbizia tratatzeko guztiz bide berria zabaltzen du immunoterapiak, zeinetan, tumorea bera itu izan beharrean, immunitate-sistema hartzen den helburu. Tumoreen immunozaintzaz hitz egitean, ostalariaren tumorearen kontrako immunitatearen eraginkortasunaz ari gara. Hori bermatzeko, ezinbestekoa da immunitate-sistemako zelula-mota desberdinek modu koordinatuan jardutea; izan ere, elkarri lotutako makina bat prozesuren ondorio konplexua da erantzun immunea.
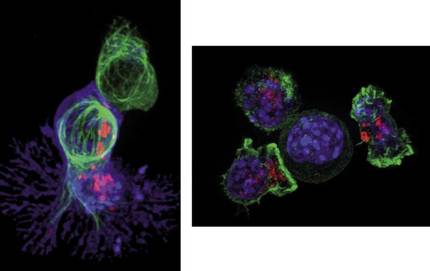
Konplexutasun horretan, T zelulek edo T linfozitoek garrantzi handia daukate erantzun immunologikoaren garapenean. Milioika T zelula ari dira une oro odolean bidaiatzen, elementu arrotzak daudenetz behatzen. Koilarakada bat odoletan 5 milioi inguru T zelula egon daiteke, ugariak bezain txikiak baitira. Batez beste, 10 mikrometroko luzera daukate, giza ile baten lodieraren hamarren bat dira, alegia. Pertsona osasuntsuetan, loaldian egon ohi dira T linfozitoak, baina arrotza den osagai edo zelularen bat detektatutakoan, hala nola minbizi-zelula bat, T zelulak zatitzen hasiko dira haren kontra egin eta suntsitzeko helburuarekin. 2. irudian ikus daiteke zer gertatzen den T zelula batek minbizi-zelula bat hautematen duenean. Behin T zelula (berdez) minbizi-zelulari (urdinez) lotzen zaionean, lehengoak zitotoxina izenaz ezagutzen diren proteina “pozoitsuak” (puntu gorriak) barneratzen dizkio minbizi-zelulari. Horren ondorioz, minbizi-zelula hil egiten da, eta T linfozitoa prest dago bere hurrengo biktima bilatzen hasteko.
Arestian esan bezala, elementu arrotza suntsitu aurretik, T linfozitoak zatitu egiten dira, kopuruz handitu eta erantzuna eraginkorragoa izan dadin. Immunitate-sistemak berak sintetizatzen duen 2-interleukina (IL-2) izeneko molekula txikiak ematen du T zelulak zatitzen hasteko seinalea. IL-2ak T zelulak ugalarazteko zer gaitasun duen ikusirik, azaleko minbizia zuen emakume baten tratamendurako erabili zen, orain hiru hamarkada. Aurretik inolako hobekuntzarik ekarri ez zioten hainbat tratamendu jasotakoa zen emakumea. IL-2az tratatutakoan baina, tumorearen ertzeko zelulen heriotza masiboa gertatu zela behatu zuten. Tumoreak uzkurtu egin ziren bi hilabeteko epean, eta hilabete batzuen ondoren, minbizi-zantzurik ez zen hauteman. Hurrengo 29 urteetan emakumeak ez du bestelako minbizirik garatu. Hori izan zen IL-2 bidezko tratamenduaren eraginkortasunaren frogatzat hartutako lehen lana, eta, hortaz, gaixoaren immunitate-sistemak tumoreak suntsitzeko duen gaitasunaren frogatzat. Lan horien ondotik, 1992tik aurrera, Droga eta Elikagaien Administrazioak (FDA) onetsita, IL-2a da azaleko minbizia eta giltzurrunetako minbiziaren kontrako ohiko tratamendua.
Tumoreek immunitate-sistema saihesteko erabiltzen dituzten trikimailuak
Baina zergatik bultzatu behar da T zelulen ugalketa? Ez al dute berez minbizi-zelulak ezagutzeko eta erasotzeko gaitasunik? Erantzuna ezezkoa da tamalez, eta, hori azaltzeko, tumorearen mikroingurunearen berezitasunei erreparatu behar diegu. Minbizia saiatuko da ostalariaren erantzun immuneari ihes egiten edota hura aldarazten, bere biziraupena eta garapena ziurtatuko badu, eta besteak beste horretarako gako diren T zelulen inhibizioa eragingo du. Kontraesana badirudi ere, tumoreetan T linfozitoez gain gaixoaren immunitate-sistemako makina bat zelula daude, baina tumorearen mikroinguruneko baldintza bereziak direla eta, zelula horien jarduera oztopatuta dago. Esaterako, tumoreetan, minbizi-zelulek eurek jariatzen dituzten eta immunitate-zelulen hazkuntza oztopatu edota haien heriotza eragiten duten molekulen kopurua izugarri handia da (TGF-beta, IL-10, E2 prostaglandina…); tumorean bertan dagoen oxigeno-kantitatea, berriz, urria da, eta baldintza horietan, tumore-zelulek bizitzeko mekanismoak garatzen dituzte, baina immunitate-zelulek ez dute horretarako gaitasunik. Gainera, erantzun immuneari ihes egiteko ahalegin horretan, minbizi-zelulek euren gainazaleko molekula-konposizioa ere aldatu egingo dute, eta, hala, sistema immunearentzako ikusezin bihurtzen dira. Hori guztia gutxi ez balitz, minbizi-zelulek immunitate-zelulen jarduera blokeatzeko ahalmena ere garatzen dute (3. irudia). Uste da mekanismo horiek guztiek elkarlanean dihardutela eta immunitate-sistemak berez minbiziari aurre egiteko duen ahalmena mugatzea lortzen dutela. Horrenbestez, ezinbestekoa da mekanismo horiek guztiak gainditzea minbizia deuseztatzeko immunoterapia eraginkorragoak garatuko badira. Eta hori da, hain zuzen ere, gaur egun jorratzen ari den bidea: immunitate-zelulen jarduera manipulatzea, tumorearen mikroingurunean izan daitezkeen kontrako baldintzak gainditu eta tumorea suntsitzeko. Hurbilketa sofistikatuenen artean daude, alde batetik, T zelulen antigeno jakin batzuen kontrako antigorputz blokeatzaileen erabilera, eta, bestetik, genetikoki eraldatutako T zelulen erabilera. Bi estrategia nagusi horiek dira arestian aipatutako Science aldizkariaren aitorpena jaso dutenak 2013an.
Norbanakoa, minbiziari eraso egiteko armarik indartsuena
Esan bezala, immunitate-zelulak ez dira gai izaten tumorea deuseztatzeko, hein handi batean, minbizi-zelulek haien jarduera blokeatzen dutelako, horretarako bide bat edo beste erabiliz. Tumoreetan ageri diren immunitate-zelulek, tartean T linfozitoek, maiz, proteina edo hartzaile bereziak adierazten dituzte gainazalean. Aldi berean, tumoreko minbizi-zelulek hartzaile horietara lotzen diren molekulak adieraz ditzakete. Kasu horietan, minbizi-zelulen eta T linfozitoen artean elkarrekintzak sortzen dira, zeintzuek T linfozitoen jarduera blokeatuko duten (3A. irudia).
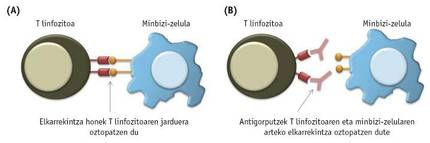
Minbizi-zelulen eta T zelulen arteko elkarrekintza kaltegarri horiek oztopatze aldera, zenbait antigorputz sintetizatu dira azken urteotan (3B. irudia). Orain arteko frogek erakutsi dutenaren arabera, arrakastatsuenak T linfozitoen PD-1 eta CTL4 hartzaileetara lotzen diren antigorputzak dira. 2011. urtean, CTLA-4 hartzaileak blokeatzen dituen farmakoa, ipilimumab deitutakoa, onetsi zuen FDAk azaleko minbizia tratatzeko. Hasiera batean, bai ipilimumab bai IL-2arekin lortutako emaitzak parekoak izan baziren ere, gerora ikusi izan da ipilimumabekin tratatutako gaixoetan tratamendua luzaroago dela lagungarria. Opdivo edo nibolumab farmakoa, zeinak T linfozitoen PD-1 hartzailea blokeatzen duen, 2014an onetsi zuen FDAk melanoma tratatzeko, eta urtebete geroago, biriketako minbiziari aurre egiteko ere onartu zuten.
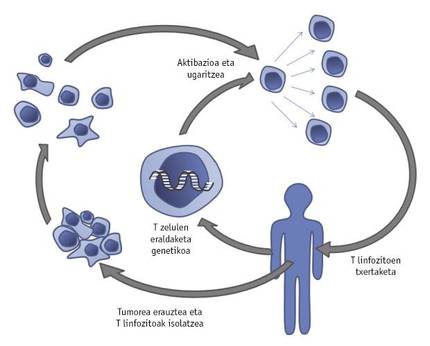
Adopziozko T zelulen transferentzia izeneko estrategia berritzailearen garapenak ere izugarriko bultzakada eman dio minbiziaren kontrako borrokari. Terapia horretan, gaixoari erauzitako tumoreko T zelulak isolatzen dira. T zelula horiek genetikoki manipulatu egingo dira, gene berriak txertatuz edota berezkoak eraldatuz, tumorearen mikroingurunean modu eraginkorragoan hazi eta jardun dezaten. Hobetutako T linfozitoen hazkuntza IL-2az sustatu ondoren, gaixoari sartuko zaizkio berriro (4. irudia).
Horren erakusle da AEBko Maryland estatuko ikertzaile-talde batek egindakoa: T zelulak genetikoki eraldatu zituzten, hantura eragiten duen IL-12 adieraz zezaten. Behin tumorean txertatuta, eraldatutako T zelulek IL-12 jariatzen dute, eta erantzun immunea oztopatzen duten minbizi-zelulen jarduera galarazten du horrek. Saguetan egindako esperimentuetan lortutako emaitza itxaropentsuak aintzat hartuta, IL-12 adierazten duten T zelula genetikoki manipulatuekin ari dira lehen froga klinikoak egiten, melanoma duten gaixoekin. Immunoterapia eraginkorrak bermatzeko, tumoreetan ohikoa den T linfozitoen gehiegizko hilkortasuna ere gainditu beharreko arazoa da. Horri aurre egiteko, T linfozitoak genetikoki eraldatu ditu ikerketa-talde berak, haien heriotza ekiditen duen Bcl-2 molekula adieraz dezaten. Molekula hori adierazten duten T linfozitoak manipulatu gabekoekin alderatuz, frogatu zuten heriotzarekiko erresistenteagoak direla lehenengoak. Arestian esan bezala, maiz, tumorearen mikroingurunean erantzun immunea oztopatuta egoten da zelula immuneak ez direlako gai tumorea ezagutzeko eta, ondorioz, horri aurre egiteko. Horren harira, frogatu dute posible dela tumoreetan dauden T zelulak genetikoki manipulatzea etengabe molekula kitzikatzaileak adieraz ditzaten eta, ondorioz, tumorea bera hauteman gabe T zelulak aktibatuta egoteko eta, hala, tumorea suntsitzeko.
Aipaturiko terapia horren arrakasta nabarmena izan da hasieratik, eta, ikerkuntzak aurrera egin ahala, haren eraginkortasuna areagotuz doa.
Berriki frogatu da adopziozko T zelulen transferentziazko terapia nabarmen eraginkorragoa dela, minbizi-gaixoak tratamendu horretan murgildu aurretik kimioterapia edota erradioterapia bidez tratatuz gero. Izan ere, terapia horiek deuseztatu egiten dute gaixoaren berezko linfozito-populazioa, eta, horren ondorioz, txertatu diren T zelula genetikoki eraldatuak modu eraginkorragoan eta denbora luzeagoz jarduteko gai dira. Tamalez, horrek baditu desabantailak ere; gaixo batzuk ez dira gai T zelularik gabeko egoera horretan aurrera egiteko.
Oraindik asko dago hobetzeko
Nahiz eta azken urteetan ikerkuntzan zein medikuntzan aurrerapauso garrantzitsuak eman diren, oraindik ere minbizia da munduan heriotza gehien eragiten duen gaitzetako bat. Ezinbestekoa izango da immunitate-sistema sakonago ezagutzea eraginkorragoak, espezifikoagoak, iraunkorragoak eta hain oldarkorrak ez diren terapia hobeak garatzeko. Ezinbestekoa izango da estrategia desberdinen arteko konbinazioak egitea, ikuspuntu biologikotik hain heterogeneoa den gaitzari behar bezala aurre egin ahal izateko.
Bibliografia

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia